
 H++OH-、HCO3-+H2O
H++OH-、HCO3-+H2O +H2CO3+OH-、HCO3-+H2O
+H2CO3+OH-、HCO3-+H2O H3O++CO32-
H3O++CO32- 分析 (1)NaHCO3溶液存在水的电离平衡、弱酸根离子的水解平衡、电离平衡;
NaHCO3溶液水解碱性;
NaHSO4溶液电离显酸性;
(2)H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,可知1molH2在0.5molO2中完全燃烧生成1.00mol液态H2O,放出285.8kJ的热量;
(3)生成2molH2O,放出114.6kJ的热量,则中和反应生成1molH2O,放出57.3kJ的热量;
(4)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol,
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
由盖斯定律可知,①-②×0.5可得C(s)+0.5O2(g)=CO(g);
(5)化学计量数为倍数关系,则K为指数关系,互为相反的两个反应的K互为倒数关系,以此来解答.
解答 解:(1)NaHCO3溶液中存在H2O


故答案为:H2O


(2)H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,可知1molH2在0.5molO2中完全燃烧生成1.00mol液态H2O,放出285.8kJ的热量,则表示H2燃烧热的热化学方程式为H2(g)+0.5O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+0.5O2(g)=H2O(l)△H=-285.8kJ/mol;
(3)生成2molH2O,放出114.6kJ的热量,则中和反应生成1molH2O,放出57.3kJ的热量,则表示其中和热的热化学方程式为0.5H2SO4(aq)+NaOH(aq)=0.5Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:0.5H2SO4(aq)+NaOH(aq)=0.5Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(4)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol,
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
由盖斯定律可知,①-②×0.5可得C(s)+0.5O2(g)=CO(g),则a=(-393.5)-(-566.0)×0.5=-110.5,
故答案为:-110.5;
(5)由N2(g)+3H2(g)?2NH3(g)的平衡常数为K1,0.5N2(g)+1.5H2(g)?NH3(g) 的平衡常数为K2,K1和K2的关系式为K1=K22;
由0.5N2(g)+1.5H2(g)?NH3(g) 的平衡常数为K2、NH3(g)?0.5N2(g)+1.5H2(g) 的平衡常数为K3,K2和K3的关系式为K2•K3=1;
由N2(g)+3H2(g)?2NH3(g)的平衡常数为K1、NH3(g)?0.5N2(g)+1.5H2(g) 的平衡常数为K3,K1和K3的关系式为K1•K32=1,
故答案为:K1=K22;K2•K3=1; K1•K32=1.
点评 本题考查化学平衡常数的含义、电离与水解、热化学反应等,为高频考点,把握相关反应原理为解答的关键,侧重分析与应用能力的考查,注意反应原理的应用,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+Na+Cu2+Al3+ |
| 阴离子 | SO42- HCO3-NO3-OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 绿色化学的核心是利用化学原理治理环境污染 | |
| C. | 将煤气化或液化,获得清洁燃料 | |
| D. | 向高空排放金属冶炼产生的粉尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
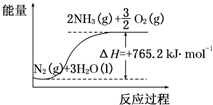 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com