
【题目】NA代表阿伏加德罗常数,下列说法错误的个数是
①标准状况下,2.24L CH2Cl2含有的分子数为0.1 NA
②1mol苯甲酸中含有双键的数目为NA
③同温同压下,2 NA个C2H4(g)与NA个C4H8(g)的密度相等
④15g甲醛(HCHO)和乙酸的混合物中氧原子数为0.5NA
A. 2个 B. 3个 C. 4个 D. 1个
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2018年11月《 Nature Energy》报道了我国科学家用 Ni-BaH2/A12O3、 Ni-LiH等作催化剂,利用化学链合成氨。回答下列问题:
(1)基态Al原子价层电子的电子排布图(轨道表达式)为___________,Ni在周期表中位于第___________族,属于___________区元素。
(2)BaH2的熔点(675℃)比CaH2(816℃)的低,其原因是___________。
(3)NH3可用于制备NaN3、NH4NO3、 (亚硝基胍)等含氮化合物:NaN3中阴离子空间构型为___________;NH4NO3中阳、阴离子中中心原子杂化方式依次为___________,亚硝基胍分子中含σ键___________个。
(亚硝基胍)等含氮化合物:NaN3中阴离子空间构型为___________;NH4NO3中阳、阴离子中中心原子杂化方式依次为___________,亚硝基胍分子中含σ键___________个。
(4)N、P位于同一主族,NH3、PH3分子结构如下图所示:

①NH3中N-H键的键长比PH3中P-H键的键长短,其主要原因是___________。
②NH3和PH3中,N、P原子杂化方式相同,但H-N-H间的夹角比H-P-H间的大,其主要原因是___________。
③NH3比PH3易液化,其主要原因是___________。

(5)该化学链合成氨过程中涉及中间化合物亚氨基锂(Li2NH),亚氨基锂是一种反荧石结构,晶体结构如上图所示(H已略去)。NA为阿伏加德罗常数的值,晶体密度为1.48g·cm-3,Li2NH的摩尔质量为28.897g·mol-1.则晶胞参数为___________nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验需要0.1mol/LNaCl溶液450ml,根据溶液配制中情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶、玻璃棒外还需要的仪器是____。
(2)根据计算得知,所需NaCl的质量为____g。
(3)所选容量瓶的规格是____。(填字母)
A.50mL的容量瓶 B.150mL的容量瓶
C.250mL的容量瓶 D.500mL的容量瓶
(4)下列操作对所配浓度的影响:偏大的有___;(填写字母)偏小的有___;无影响的有__。
A.称量用了生锈的砝码; B.往容量瓶转移时,有少量液体溅出;
C.未洗涤溶解NaCl的烧杯; D.容量瓶未干燥即用来配制溶液;
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成橡胶可以利用以下途径:
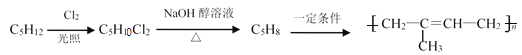
(1)C5H12同分异构体共有_____种,其中核磁共振H谱图只有1种的结构简式为________。
(2)下列有关上述的C5H8说法正确的是_____________。
A.所有的原子可能共平面 B.和溴水、溴的四氯化碳反应的现象不完全相同
C.所有C原子可能共平面 D.和溴的四氯化碳溶液反应生成产物最多有2种
(3)写出分子式C5H8属于炔烃的所有同分异构体的结构简式_____________________。
(4)写出下列反应的化学方程式(注明反应条件):
①C5H12→C5H10Cl2:_______________________________________________________。
②C5H10Cl2→C5H8:_____________________________________________________。
(5)以乙烷为原料可合成聚氯乙烯。请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: __________
__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某盐酸36.5g,其中HCl的质量分数为10%,盐酸密度为1.05g/cm3。试计算:
(1)求HCl物质的量?____
(2)求HCl的物质的量浓度是多少?(保留两位小数)____
(3)此盐酸中所含水的物质的量是多少?____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上常利用电解含有铁、钯、铜等金属的粗银棒精炼银,示意图如下:
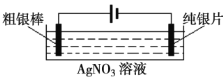
(1)阴极反应式为___________。
(2)精炼过程中,AgNO3溶液的浓度将___________(填“增大”、“减小”或“不变”);原因是___________。
Ⅱ.“钯(Pd)金”不仅是优异的催化剂,也是首饰界的新宠。精炼银的过程中钯元素可在电解液中大量富集,因此工业上常利用精炼银的电解液[主要成分为:AgNO3、Pd(NO3)2、Cu(NO3)2、Fe(NO3)3、Ni(NO3)2、HNO3等]为原料生产“钯金”,流程如下:
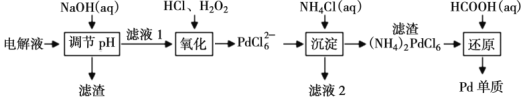
(3)定量实验检测表明,当滤液1中c(Ni2+)=2×10-3mol·L-1时,Pd2+仍没有开始沉淀,计算此时溶液中c(Fe3+)=___________,(Ksp[Ni(OH)2]=2.0×10-15、Ksp[Fe(OH)3]=4.0×10-38)。
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为___________。
(5)为保证产品的纯净,“沉淀”过程中所得滤渣需要洗涤,简述检验滤渣是否洗净的实验方法___________。
(6)写出“还原”步骤中发生反应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
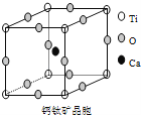
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__、__个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是__.该物质的化学式可表示为__。
(3)若钙、钛、氧三元素的相对原子质量分别为a,b,c,晶体结构图中正方体边长(钛离子之间的距离)为dnm(1nm=10﹣9m),则该晶体的密度为__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺能吸收SO2降低环境污染,同时又能制得氢气。用稀土吸收H2后的储氢材料作为电极材料,以KOH溶液作电解质溶液(电池内部气体可从一个电极扩散到另一个电极)形成的可逆电池的总反应为NiO(OH)十MH ![]() Ni(OH)2+M。下列说法不正确的是
Ni(OH)2+M。下列说法不正确的是
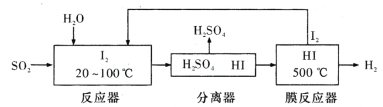
A. 反应器中发生反应的离子方程式是SO2+I2+2H2O![]() 4H++SO42-+2I-
4H++SO42-+2I-
B. 分离器中的副产品是硫酸
C. 过程中循环利用的物质是I2
D. 该电池充电完后若持续充电,在一个电极上会产生O2而使电池发生爆炸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com