
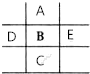
 如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )
如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )| A. | 铝 | B. | 镁 | C. | 磷 | D. | 硫 |
分析 C元素原子次外层电子数为18,C原子核外有四个电子层,处于第四周期,则A处于第二周期,B、D、E处于第三周期,A,B,C,D,E五种元素原子核外共有85个电子,令B的核外电子数为x,则D核外电子数为x-1,E核外电子数为x+1,A核外电子数为x-8,C核外电子数为x+18,列方程计算x的值,进而确定各元素解答.
解答 解:C元素原子次外层电子数为18,C原子核外有四个电子层,处于第四周期,则A处于第二周期,B、D、E处于第三周期,A,B,C,D,E五种元素原子核外共有85个电子,令B的核外电子数为x,则D核外电子数为x-1,E核外电子数为x+1,A核外电子数为x-8,C核外电子数为x+18,
则:x-1+x+x+1+x-8+x+18=85,解得x=15,故B为P元素,
故选C.
点评 本题考查了元素周期表的应用和元素推断,题目难度不大,注意理解掌握同主族元素原子序数关系,侧重于考查学生的分析能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Fe3+、I-、Cr- | NaOH溶液 | Fe3++30H-═Fe(0H)3↓ |
| B | K+、NH3•H20、CO32- | 通人少量CO2 | 20H-+C02═CO32-+H20 |
| C | H+,Fe2+、SO42- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl- | 少量澄淸石灰水 | Al3++30H-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①和②都是离子反应 | B. | 反应①和②都吸收热量 | ||
| C. | 反应①和②都放出热量 | D. | 反应③既不吸收热量也不放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 47.87是丰度最高的钛原子的相对原子质量 | |
| B. | 钛原子的M层上共有10个电子 | |
| C. | 从价电子构型看,钛属于某主族元素 | |
| D. | 22为钛原子的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32-不能大量共存,因有Al2(CO3)3沉淀生成 | |
| B. | 含大量Fe3+的溶液中:K+Mg2+、I-、Br2-不能大量共存,因2Fe3++2I-=2Fe2++I2 | |
| C. | 由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、NO3-、HCO3-、Cl-不能大量共存,因溶液呈酸性,与HCO3-反应产生CO2气体 | |
| D. | 在NH4Fe(SO4)2溶液中:Na+、K+、S2-、SCN-不能大量共存,只是因Fe3+和S2-反应产生淡黄色的S沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
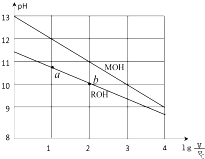 室温下,将浓度均为0.10mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述错误的是( )
室温下,将浓度均为0.10mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述错误的是( )| A. | ③⑤ | B. | ①⑤ | C. | ①③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com