
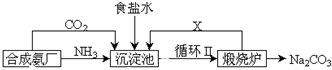
分析 (1))①从CO2在水中打的溶解度不大、而NH3极易溶于水来分析;
②煅烧炉内分解的是碳酸氢钠,产物为CO2和水,而沉淀池中需要通入的气体为CO2;
③煅烧炉内碳酸氢钠受热分解生成碳酸钠、CO2和水;
(2)50mL2mol•L-1NaOH溶液制取50mL1mol•L-1纯碱溶液,可知不需要另外向溶液里增加Na+,如果直接通CO2,恰好完全反应时生成碳酸钠,如果CO2的量不足将混有NaOH,CO2过量将有NaHCO3生成,可结合反应NaHCO3+NaOH=Na2CO3+H2O选择实验方法;
解答 解:(1)①氨气极易溶于水,而二氧化碳微溶于水,先通入氨气,溶液呈碱性,再通入二氧化碳气体可之更多地转化为HCO3-,故答案为:因为NH3极易溶于水且溶液呈弱减性,再通入CO2使之更多地转化为HCO3-;
②碳酸氢钠受热分解生成碳酸钠、CO2和水,可将CO2通入沉淀中循环利用,故X为CO2,故答案为:CO2;
③碳酸氢钠受热分解的化学方程式为2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+CO2↑+H2O,故答案为:2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)①将50mL2mol•L-1NaOH溶液均匀分成二等份;Ⅱ、向其中一等份中通入过量CO2气体;Ⅲ、将另一等份NaOH溶液加入步骤Ⅱ所得溶液中,并充分混合,即得到50mL1mol•L-1纯碱溶液;故答案为:将50mL2mol•L-1NaOH溶液分成二等份,向其中一份中通入过量CO2气体,然后将另一份NaOH溶液倒入并充分混合,可得50mL1mol•L-1纯碱溶液;
②NaOH溶液里通入过量CO2气体发生反应的化学方程式为NaOH+CO2=NaHCO3,碳酸氢钠溶液里加入NaOH溶液发生反应的化学方程式为NaHCO3+NaOH=Na2CO3+H2O,故答案为:NaOH+CO2=NaHCO3、NaHCO3+NaOH=Na2CO3+H2O.
点评 本题以侯氏制碱法为载体,探究实验的操作原理及纯碱的制备实验设计,基础考查,但培养了学生分析问题,解决问题的能力,特别是碳酸钠的制备方法是难点,整体难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取28.6g Na2CO3•10H2O晶体 | |
| B. | 将Na2CO3固体放入容器瓶中,加水至刻度线 | |
| C. | 定容时俯视液面,所得溶液浓度偏低 | |
| D. | 加水时不慎超过刻度线,用胶头滴管直接吸出多余液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
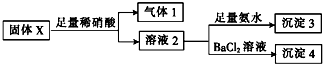
| A. | 气体1一定含NO可能含CO2 | |
| B. | 沉淀3一定含Mg(OH)2一定不含Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有MgCl2和Na2SO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全氧化56g Fe需要消耗氯气33.6 L | |
| B. | 7.8g Na2O2溶于100ml水,转移电子数为0.1NA | |
| C. | 向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol | |
| D. | 利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它有利于儿童牙齿的生长 | |
| B. | 它有利于骨骼的生长和发育 | |
| C. | 它有利于化合物Ca10(PO4)6(OH)2的生成 | |
| D. | 它使儿童更聪明 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 118号元素的相对原子质量为293 | |
| B. | 118号元素的一种同位素${\;}_{118}^{293}$Pb的质量数为293 | |
| C. | 118号元素的一种同位素${\;}_{118}^{293}$Pb的中子数为293 | |
| D. | 118号元素应为周期表中第8周期的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com