
下列化学用语表示不正确的是()
A. Na+的结构示意图  B. 四氯化碳的电子式
B. 四氯化碳的电子式 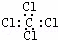
C. 二氧化碳的结构式为O=C=O D. 乙烯的实验式为 CH2
考点: 电子式、化学式或化学符号及名称的综合.
专题: 化学用语专题.
分析: A.钠离子的核电荷数为11,核外电子总数为10,最外层达到8电子稳定结构;
B.四氯化碳分子中,氯原子最外层达到8电子稳定结构,漏掉了氯原子的3对未成键电子;
C.二氧化碳为直线型结构,分子中存在两个碳氧双键;
D.乙烯的分子式为:C2H4,根据其分子式写出其实验式.
解答: 解:A.钠离子与钠原子的核电荷数都是11,钠离子最外层电子为8,核外电子总数为10,钠离子的结构示意图为: ,故A正确;
,故A正确;
B.四氯化碳为共价化合物,氯原子和碳原子最外层都达到8电子稳定结构,四氯化碳正确的电子式为: ,故B错误;
,故B错误;
C.二氧化碳为共价化合物,分子中存在两个碳氧双键,且为直线型结构,二氧化碳的结构式为:O=C=O,故C正确;
D.实验式又称为最简式,是分子中各原子的最简比,乙烯的分子式为:C2H4,则其实验式为CH2,故D正确;
故选B.
点评: 本题考查了电子式、离子结构示意图、结构式、实验式的表示方法判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,明确实验式、分子式、结构式、电子式的区别,试题培养了学生灵活应用所学知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某小河边有四座工厂:甲、乙、丙、丁(如图所示).已知,它们所排出的废液里分别含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现:①甲处河水呈乳白色②乙处河水呈红褐色浑浊状③丙处河水由浑浊变清④丁处河水产生气泡,河水仍澄清.
请推断:
(1)四座工厂排出的废液里含有的污染物是甲 ,乙 ,丙 ,丁 .
在M处取出的河水中,肯定大量存在的离子有 .
(3)用离子方程式表示丙除河水变澄清的原因: .
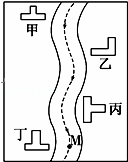
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计及其对应的离子方程式均正确的是()
A. 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+
B. Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH﹣+O2↑
C. 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl﹣+ClO﹣
D. 用惰性电极电解饱和氯化钠溶液:2Cl﹣+2H+ H2↑+Cl2↑
H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同状况下,一个空瓶,若装满O2称其质量为36g,若装满CO2称其质量为42g,若装满A气体,称其质量为52g,则A的相对分子质量是()
A. 16 B. 32 C. 64 D. 128
查看答案和解析>>
科目:高中化学 来源: 题型:
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是 、
(2)下列有关配制过程中说法错误的是 (填序号).
a.用电子天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90nL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br﹣被C12氧化成Br2溶解在溶液中; 假设2:Fe2+被C12氧化成Fe3+.
(1)请你完成表格,验证假设:
实验步骤、预期现象 结论
①溶液中加入适量四氯化碳 假设1正确
②向溶液中加入 假设2正确
若假设1正确,从实验①中分离出Br2的实验操作名称是 ;
(2)实验证明:还原性Fe2+>Br﹣,请用一个离子方程式来证明: ;
(3)若在50mL上述FeBr2溶液中通入5×10﹣3molCl2,反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有I﹣、Cl﹣、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水和CCl4振荡静置后,下层呈紫红色,取上层溶液少许,向其中加入AgNO3溶液时,产生的白色沉淀不溶于稀硝酸.
对于下列微粒不能确认其在溶液中是否存在的是()
A. I﹣ B. Cl﹣ C. H2SO3 D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是()
A. NaClO溶液的消毒原理是使蛋白质变性
B. 1 mol Cl2与足量NaOH溶液反应转移2 mol电子
C. NaClO溶液的漂白原理与Na2O2相同,与SO2不同
D. “84”消毒液与“洁厕灵”(盐酸)混合使用可能会产生有毒的氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断不正确的是(不计CO2溶解)()
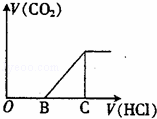
A. 若OB=0,则形成溶液M所发生反应的离子方程式为OH﹣+CO2═HCO3﹣
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32﹣和HCO3﹣
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com