
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:

请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是_____。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为_____、_______。
(3)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、H2O、_____、______(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56akgA(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36bkgA和1.12ckg 铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料______kg。
【答案】TiO2+2H2SO4=Ti(SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O Fe+2Fe3+=3Fe2+ Fe +2H+=Fe2++H2↑ FeSO4 H2SO4 1.60a+3.20b+1.60c
【解析】
(1)依据流程分析,硫酸与二氧化钛反应是发生的复分解反应;
(2)钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料溶解于硫酸过滤后得到滤液中含有铁离子、亚铁离子、过滤的硫酸,加入铁粉和铁离子反应,和酸反应;
(3)影响钛盐水解的因素有浓度、温度等,由Ti(SO4)2水解呈酸性,沸水、高温水蒸气、维持溶液沸腾等均为升温,沸水、高温水蒸气加水且降低H+浓度,故高温水蒸气使水解平衡移动的作用是:加水、加热、降低H+浓度均可促进钛盐水解;
(4)考虑最后溶质是只有硫酸钠和硫酸铁,根据开始加入A为2a×103mol,加入适量氢氧化钠溶液恰好完全反应,说明加入氢氧化钠的物质的量为4a×103mol,后来又加入12b×103mol的A和2c×103mol的铁,根据电荷守恒,溶质中硫酸钠消耗硫酸根离子为2a×103mol,而溶液中加入的硫酸根离子物质的量共计为(2a+12b)×103mol,这样剩下的硫酸根就与铁离子结合。可知消耗铁离子为8b×103mol,根据铁元素守恒计算。
(1) 依据酸的通性,可以与金属氧化物反应,又知道Ti的化合价,可以写出化学方程式为TiO2+2H2SO4=Ti (SO4)2+2H2O或TiO2+H2SO4=TiOSO4+H2O;
(2)浓硫酸有强氧化性,加入钛铁矿渣中能生成Fe3+,加入铁粉,发生Fe+2Fe3+=3Fe2+;铁粉还可以与溶液中过量的H+反应,离子方程式为:Fe+2H+=Fe2++H2↑;
(3) 根据该工艺流程知:滤液Ⅲ的主要成分为大量的钛盐、溶解的硫酸亚铁、少量的硫酸(混合液pH达0.5)等,钛盐水解后过滤去水合二氧化钛,得到的滤液中含有未水解的钛盐及FeSO4、H2SO4、H2O等,故答案为:FeSO4;H2SO4;
(6)依题意A与适量氢氧化钠溶液恰好完全反应,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,根据开始加入A为2a×103 mol,可知加入氢氧化钠为4a×103 mol;后来又加入12b×103 mol的A和20c mol的铁,由Na2SO4、FeSO4、Fe2(SO4)3、Fe2O3等化学式的定量组成和守恒思想分别可求得以下各量:利用Na+离子守恒,n(NaOH)=2n(Na2SO4),可知Na2SO4物质的量为20a mol;利用SO42-离子守恒,n(FeSO4)=n(Na2SO4)+3n[Fe2(SO4)3],可知Fe2(SO4)3物质的量为(20a+120b-20a) mol×![]() =40bmol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2 n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2) mol×
=40bmol;利用Fe元素守恒,n(FeSO4)+n(Fe)=2 n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2) mol×![]() =(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c) kg,故答案为:1.60a+3.20b+1.60c。
=(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c) kg,故答案为:1.60a+3.20b+1.60c。


科目:高中化学 来源: 题型:
【题目】钠硫电池体积小、容量大、寿命长、效率高,在电力储能中广泛应用于削峰填谷、应急电源、风力发电等储能方面。Na-S电池的结构如下图所示,电池反应为2Na+![]() S8=Na2Sn。下列说法不正确的是( )
S8=Na2Sn。下列说法不正确的是( )
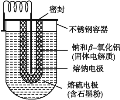
A. 熔钠电极作电池的负极B. 放电时Na+向正极移动
C. 充电时熔钠电极与电源的正极相连D. 充电时阳极反应式为8Sn2--16e-=nS8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,中国科学家屠呦呦因为创制了新型抗疟药﹣﹣青蒿素,获得诺贝尔生理学或医学奖.青蒿素可由香茅醛为原料制取,下列说法不正确的是( )

A.香茅醛能使Br2的CCl4溶液褪色
B.青蒿素分子式为C15H22O5
C.青蒿素在一定条件下可发生水解反应
D.二者均可与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B的分子式均为C10H10O5,均能发生如下变化。
已知:
1.A、B、C、D均能与NaHCO3反应
2.只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种
3.F能使溴水褪色
4.H不能发生银镜反应
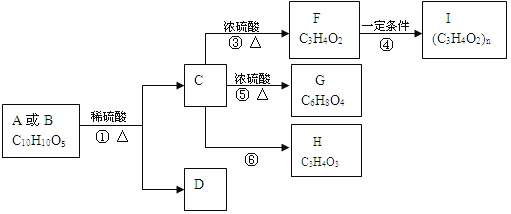
根据题意回答下列问题:
(1)反应③的反应类型是_____;有机物F含氧官能团的名称是_____。
(2)写出有机物的结构简式A__________、H_________。
(3)写出反应⑤的化学方程式_______________。
(4)D的同分异构体有很多种,写出同时满足下列要求的所有同分异构体的结构简式:____。
①能与FeCl3溶液发生显色反应 ②能发生银镜反应但不能水解 ③苯环上的一卤代物只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知干冰晶胞结构属于面心立方最密堆积,晶胞中最近的相邻两个CO2 分子间距为apm,阿伏加德罗常数为NA,下列说法正确的是( )
A. 晶胞中一个CO2分子的配位数是8
B. 晶胞的密度表达式是![]()
C. 一个晶胞中平均含6个CO2分子
D. CO2是极性分子,易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均反应速率v(X)为
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均反应速率v(X)为
A. v(NH3)= 0.004molL-1s-1B. v(O2)= 0.15molL-1min-1
C. v(NO)= 0.008molL-1s-1D. v(H2O)= 0.16molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在1L的密闭容器中充入NO2发生如下反应:2NO2(g)![]() N2O4(g)△H=-57 kJ·mol-1(N2O4在25℃时为无色气体)。
N2O4(g)△H=-57 kJ·mol-1(N2O4在25℃时为无色气体)。
(1)该反应的ΔS__________0(填“>”、“<”或“=”)。
(2)当开始充入0.03mol的NO2时,25℃时,实验测得NO2的平衡浓度为0.01 mol·L-1,则NO2的平衡转化率(α)是_____________。25℃时上述反应的平衡常数K =_________。
(3)25℃时,实验测得该反应的活化能Ea=92.4 kJ·mol-1。下列能量关系图合理的是_____。
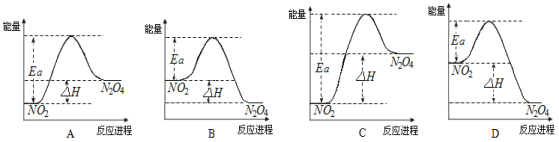
(4)如把该密闭容器放入80℃的热水中,则气体的颜色___________(填“不变”、“加深”或“变浅”),NO2的转化率___________(填“增大”、“不变”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com