
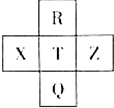
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:X<T<Q | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 简单离子的还原性:T>Q |
分析 R单质在暗处与H2剧烈化合并发生爆炸,R为F元素,由元素在周期表中的位置可知,T为Cl元素,Q为Br元素,X为S元素,Z为Ar元素,结合元素周期律解答.
解答 解:R单质在暗处与H2剧烈化合并发生爆炸,R为F元素,由元素在周期表中的位置可知,T为Cl元素,Q为Br元素,X为S元素,Z为Ar元素,
A.同主族元素从上到下非金属性逐渐减弱,Q<T,故A错误;
B.R为F元素,Q为Br元素,原子序数相差26,故B正确;
C.同主族自上而下,非金属性减弱,故非金属性F>Cl>Br,非金属性越强,气态氢化物越稳定,故稳定性HF>HCl>HBr,故C错误;
D.非金属性Q<T,元素的非金属性越强,对应的简单离子的还原性越弱,故D错误.
故选B.
点评 本题考查结构位置性质关系、元素周期表的结构、元素周期律等,为高频考点,难度不大,推断R为氟元素是关键,注意掌握元素周期律.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 仅③⑤ | B. | 仅②④ | C. | 仅②⑤ | D. | 仅⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
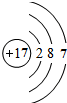 ,NH4Cl的电子式
,NH4Cl的电子式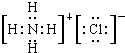 ;
;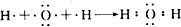 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种 | |
| B. | 原子晶体的熔点一定比金属的高 | |
| C. | 构成分子晶体的微粒一定含有共价键 | |
| D. | 晶体中只要有阳离子就一定有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
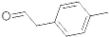
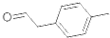 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(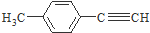 )的一条路线如下:
)的一条路线如下: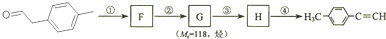
 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个;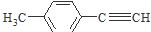 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;| 序号 | 所加试剂及反应条件 | 反应类型 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应与能量有着密不可分的关系,回答下列问题.
化学反应与能量有着密不可分的关系,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2 | B. | CCl4和Fe | C. | CaCl2和HCl | D. | SO3和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
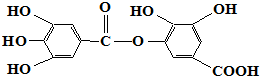
| A. | 常温下可以和Na2CO3溶液反应生成CO2气体 | |
| B. | 在碱性条件下水解,0.5mol该物质完全反应可以消耗4mol NaOH | |
| C. | 与稀H2SO4共热生成两种不同的有机物 | |
| D. | 该物质的化学式为C14H10O9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2 OH-=Cu(OH)2↓ | |
| B. | 用小苏打(NaHCO3)治疗胃酸(主要成分是盐酸)过多:CO32-+H+═CO2↑+H2O | |
| C. | 将少量二氧化碳气体通入澄清石灰水中:2OH-+CO2═CO32-+H2O | |
| D. | 稀硫酸与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com