【答案】
分析:Ⅰ(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
该反应正反应是放热反应,升高温度平衡向逆反应方向移动,据此判断温度对平衡常数的影响;
(2)根据v=
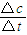
计算v(NH
3),再根据速率之比等于化学计量数之比计算v(H
2);
(3)若平衡时,移走1mol N
2和3mol H
2,等效为原平衡体积增大一倍,降低压强,若平衡不移动,则c(NH
3)=0.25mol/L,但平衡向逆反应移动;
Ⅱ(1)0.4mol/LCH
3COOH溶液和0.2mol/LNaOH溶液各100mL混合,反应后的溶液中含CH
3COOH、CH
3COONa各0.02mol,溶液pH=5,说明醋酸的电离程度大于醋酸根的水解程度,据此判断排序;
(2)①根据物料守恒计算;
②根据物料守恒、电荷守恒计算;
Ⅲ.根据Ksp[Fe(OH)
3]=c(Fe
3+)?c
3(OH
-),Kw=c(H
+)?c(OH
-)及Fe(OH)
3+3H
+?Fe
3++3H
2O的平衡常数表达式,可得3个常数的关系,进行计算.
根据Ksp[Fe(OH)
3]=c(Fe
3+)?c
3(OH
-)计算c(OH
-),再根据Kw=c(H
+)?c(OH
-)计算c(H
+),最后根据pH=-lgc(H
+)计算.
解答:解:Ⅰ(1)N
2(g)+3H
2(g)?2NH
3(g)平衡常数k=
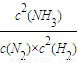
,该反应正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数变小,
故答案为:

;变小;
(2)5min后达到平衡,测得c(NH
3)=0.5mol/L,则v(NH
3)=
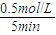
=0.1mol/(L?min),速率之比等于化学计量数之比,v(H
2)=1.5v(NH
3)=1.5×0.1mol/(L?min)=0.15mol/(L?min);
故答案为:0.15mol/(L?min);
(3)若平衡时,移走1mol N
2和3mol H
2,等效为原平衡体积增大一倍,降低压强,若平衡不移动,则c(NH
3)=0.25mol/L,但平衡向逆反应移动,故平衡时c(NH
3)<0.25mol/L,
故答案为:<;
Ⅱ(1)0.4mol/LCH
3COOH溶液和0.2mol/LNaOH溶液各100mL混合,反应后的溶液中含CH
3COOH、CH
3COONa各0.02mol,溶液pH=5,溶液呈酸性,则c(H
+)>c(OH-),说明醋酸的电离程度大于醋酸根的水解程度,则c(CH
3COO
-)>c(Na
+),醋酸是弱电解质,不能完全电离,则c(Na
+)>c(H
+),故离子浓度由大到小的顺序是:c(CH
3COO
-)>c(Na
+)>c(H
+)>c(OH
-),
故答案为:c(CH
3COO
-)>c(Na
+)>c(H
+)>c(OH
-);
(2)①反应后的溶液中含CH
3COOH、CH
3COONa各0.02mol,溶液体积为200mL,根据物料守恒可知,c(CH
3COO
-)+c(CH
3COOH)=

=0.2moL/L,
故答案为:0.2;
②根据物料守恒有:c(CH
3COO
-)+c(CH
3COOH)=2c(Na
+),
根据电荷守恒有:c(Na
+)+c(H
+)=c(OH
-)+c(CH
3COO
-),
整理得:c(CH
3COO
-)+c(CH
3COOH)=2[c(OH
-)+c(CH
3COO
-)-c(H
+)]
即c(CH
3COO
-)-c(CH
3COOH)=2[c(H
+)-c(OH
-)]=2×(10
-5-10
-9)mol/L
故答案为:2×(10
-5-10
-9);
8Ⅲ.Fe(OH)
3+3H
+?Fe
3++3H
2O的平衡常数表达式k=
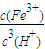
,由Ksp[Fe(OH)
3]=c(Fe
3+)?c
3(OH
-),Kw=c(H
+)?c(OH
-),可知式k=
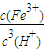
=
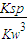
=
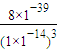
=8×10
3,
向0.001mob/L FeCl
3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液中c(OH
-)=
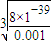
=2×10
-12mol/L,故c(H
+)=
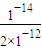
=5×10
-3mol/L,故pH=-lgc(H
+)=-lg5×10
-3=2.3,
故答案为:8×10
3;2.3.
点评:本题属于拼合型题目,涉及化学平衡与反应速率、盐类水解、平衡常数的有关计算等,题目综合性较大,难度中等,是一道不错的能力考查题,注意基础知识的理解掌握.

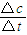 计算v(NH3),再根据速率之比等于化学计量数之比计算v(H2);
计算v(NH3),再根据速率之比等于化学计量数之比计算v(H2);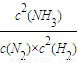 ,该反应正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数变小,
,该反应正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数变小, ;变小;
;变小;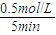 =0.1mol/(L?min),速率之比等于化学计量数之比,v(H2)=1.5v(NH3)=1.5×0.1mol/(L?min)=0.15mol/(L?min);
=0.1mol/(L?min),速率之比等于化学计量数之比,v(H2)=1.5v(NH3)=1.5×0.1mol/(L?min)=0.15mol/(L?min); =0.2moL/L,
=0.2moL/L,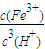 ,由Ksp[Fe(OH)3]=c(Fe3+)?c3(OH-),Kw=c(H+)?c(OH-),可知式k=
,由Ksp[Fe(OH)3]=c(Fe3+)?c3(OH-),Kw=c(H+)?c(OH-),可知式k=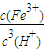 =
=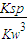 =
=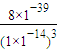 =8×103,
=8×103,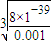 =2×10-12mol/L,故c(H+)=
=2×10-12mol/L,故c(H+)=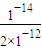 =5×10-3mol/L,故pH=-lgc(H+)=-lg5×10-3=2.3,
=5×10-3mol/L,故pH=-lgc(H+)=-lg5×10-3=2.3,


 .
.
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.