
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式 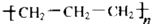 | ||
| C. | 四氯化碳分子的电子式 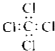 | D. | 丙烷分子的球棍模型  |
分析 A、醛基中-H连在C原子上;
B、聚丙烯的结构单元的主链含有2个C原子;
C、氯原子未成键的孤对电子对未标出;
D、球棍模型突出的是原子之间的成键的情况及空间结构.
解答 解:A、醛基中-H连在C原子上,故醛基的结构简式为-CHO,故A错误;
B、聚丙烯为丙烯通过加聚反应生成的,聚丙烯的结构简式为: ,故B错误;
,故B错误;
C、氯原子未成键的孤对电子对未标出,四氯化碳电子式为 ,故C错误;
,故C错误;
D、 原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故D正确.
原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故D正确.
故选D.
点评 考查常用化学用语的书写,难度不大,掌握常用化学用语的书写,注意比例模型突出的是原子之间相等大小以及原子的大致连接顺序、空间结构,不能体现原子之间的成键的情况.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:实验题
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下: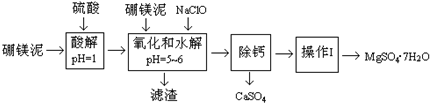
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;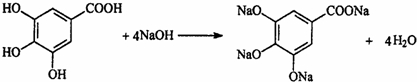 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
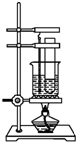 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2NH中N的化合价是-1 | B. | LiH的电子式为Li+:H- | ||
| C. | 该反应中H2既是氧化剂又是还原剂 | D. | LiNH2是还原产物,LiH是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| J | ||||
| R | T |
 .
.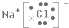 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com