



 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
| A、A、B、C的分子数比为1:3:2 |
| B、A、B、C的浓度相等 |
| C、C生成的速率与C分解的速率相等 |
| D、单位时间生成n mol A,同时生成3n mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知氧化性:Au3+>Ag+>Cu2+>Pb2+>Cr3+>Zn2+>Ti2+.现有如图所示的电化学装置,下列叙述中正确的是( )
已知氧化性:Au3+>Ag+>Cu2+>Pb2+>Cr3+>Zn2+>Ti2+.现有如图所示的电化学装置,下列叙述中正确的是( )| A、若X为Ti,则Y极的电极反应式可能是Zn-2e-═Zn2+ |
| B、若X为Cr,则Y可以选Zn或Ti |
| C、若Y为Cu,则X极的电极反应式可能是Cr-3e-═Cr3+ |
| D、若Y为Pb,则Xn+(aq)中阴离子数会减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
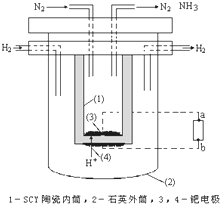 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂 | 操作步骤 | 发生现象 | 结论 | |
| ①氢氧化铜 |
a.将尿液与试剂混合振荡 | 甲.蓝色溶液 | ||
| 乙.生成绿色沉淀 |
||||
| ②斐林试剂 |
b.将尿液与试剂混合后加热至沸腾 | |||
| 丙.生成黄绿色沉淀 | ||||
| ③硫酸铜 | c.将尿液与试剂混合后微热 |
丁.生成黄色沉淀 | ||
| 戊.生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.Imol/LNaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.Imol/LNaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com