
| ① | ② | ③ | 实验结论 |  | |
| A | 浓醋酸 | CaCO3 | Ca(ClO)2 | 酸性:醋酸>碳酸>次氯酸 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | CuS | KMnO4 | H2S具有还原性 | |
| D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A.醋酸易挥发,③中变浑浊可能为醋酸与Ca(ClO)2的反应;
B.浓硫酸具有脱水性,使蔗糖变为C,且浓硫酸具有强氧化性,与C发生氧化还原反应生成的二氧化硫能使溴水褪色;
C.硫酸不与硫化铜反应;
D.比较非金属性可利用最高价氧化物对应水化物的酸性强弱,而盐酸为无氧酸.
解答 解:A.醋酸易挥发,③中变浑浊可能为醋酸与Ca(ClO)2的反应,则图中装置不能确定碳酸与次氯酸的酸性强弱,故A错误;
B.浓硫酸具有脱水性,使蔗糖变为C,且浓硫酸具有强氧化性,与C发生氧化还原反应生成的二氧化硫能使溴水褪色,按照图中装置发生的实验现象能说明浓硫酸的性质,故B正确;
C.硫酸不与硫化铜反应,无硫化氢生成,故C错误;
D.比较非金属性可利用最高价氧化物对应水化物的酸性强弱,而盐酸为无氧酸,图中装置只能说明酸性的强弱,不能得出非金属性的强弱,故D错误;
故选B.
点评 本题考查实验方案的设计及评价,为高频考点,明确物质的性质及常见气体的制取原理、装置是解答本题的关键,注意设计实验应排除干扰,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g金属铁与足量的稀硫酸反应失去的电子数为0.3NA | |
| B. | 常温常压下,22.4L O2中含有氧原子个数为2NA | |
| C. | 2.8 g CO与等质量的C2H4含有相等的分子数,都为0.1NA | |
| D. | 1 mol•L-1NaCl溶液中含有Cl-的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间 (min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
| A. | 分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>④>③ | |
| B. | 五种溶液中,水电离出的c(H+)最小的是⑤ | |
| C. | 将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 在⑤中加入适量的④至溶液呈中性,所得溶液中c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
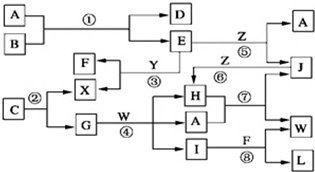
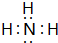
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
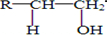 $→_{△}^{浓硫酸}$R-CH=CH2+H2O)
$→_{△}^{浓硫酸}$R-CH=CH2+H2O)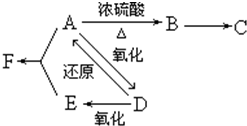
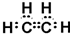 .
.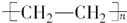
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由苯制硝基苯;由苯制环己烷 | |
| B. | 由乙烯制1,2-二溴乙烷;由乙烷制一氯乙烷 | |
| C. | 乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 由苯制溴苯;由乙烷与氯气在光照下的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com