
| A. | ①② | B. | ②③④ | C. | ①③⑤ | D. | ②⑤ |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
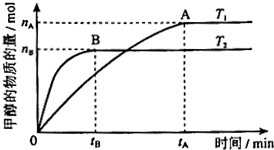 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在限量范围内使用不会对人体造成危害 | |
| B. | 只有不法商贩才使用食品添加剂 | |
| C. | 不使用食品添加剂的纯天然食品最安全 | |
| D. | 食品添加剂就是为食品好卖出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 向水中加入少量稀硫酸,c(H+)增大,KW不变 | |
| C. | 向水中加入氨水,水的电离平衡向正反应方向移动,c(OH-)增大 | |
| D. | pH=3的醋酸溶液,稀释至10倍后pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成H2和O2时,化学能主要转化为电能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,热能主要转化为化学能 | |
| D. | 白炽灯工作时,只发生电能转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
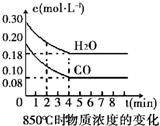
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
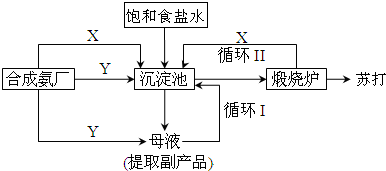
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com