
| A. | 氯化钠加热融化 | B. | 氢氧化钠溶于水 | ||
| C. | 氯化氢气体溶于水 | D. | 酒精溶于水 |
科目:高中化学 来源: 题型:选择题
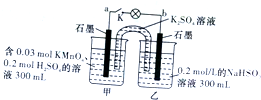
| A. | 电池工作时,甲烧杯中由烧杯中由水电离出的c(H+)逐渐减小 | |
| B. | 电池工作时,盐桥中的“K+”移向甲烧杯,外电路的方向是从b到a | |
| C. | 当电路中有1.204×1021个电子转移时,乙烧杯中溶液的pH约为2 | |
| D. | 乙池中的氧化产物为SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a(干燥气体) | b(液体) | 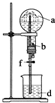 | |
| A | NO | 水 | |
| B | CO2 | 4mol•L-1NaOH溶液 | |
| C | Cl2 | 饱和NaCl溶液 | |
| D | NH3 | 热的浓的NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 1.6gNH2-离子所含质子数为NA | |
| C. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| D. | 9g D216O所含的中子数为4.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④<⑤<①<②<③ | B. | ⑤<④<③<②<① | C. | ①<②<④<③<⑤ | D. | ①<②<③<④<⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
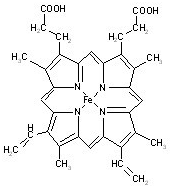 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.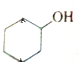 )中有3个手性碳原子.
)中有3个手性碳原子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com