

分析 88gCO2为2mol,45gH2O为2.5mol,标况下11.2L烃A为0.5mol,所以烃A中含碳原子为4,H原子数为10,则A的学式为C4H10,C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照发生一氯取代时有两种产物,且在NaOH醇溶液作用下发生消去反应的产物只有一种,则A只能是异丁烷,取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,故D为CH2=C(CH3)2,D与溴发生加成反应生成E为CH2BrCBr(CH3)2,E生成碱性水解得F为CH2OHCOH(CH3)2,以此解答该题.
解答 解:(1)标准状况下,11.2L的烃A在氧气中充分燃烧可以产生88g CO2和45g H2O,88gCO2的物质的量为$\frac{88g}{44g/mol}$=2mol,45gH2O的物质的量为$\frac{45g}{18g/mol}$=2.5mol,标况下11.2L烃A为0.5mol,所以烃A中含碳原子为$\frac{2}{0.5}$=4,H原子数为$\frac{2.5×2}{0.5}$=10,则A的学式为C4H10,
故答案为:C4H10;
(2)B和C均为一氯化烃,它们的名称(系统命名)分别为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,已知C中只有一种等效氢,则C为2-甲基-2-氯丙烷,则B为 2-甲基-1-氯丙烷,
故答案为:2-甲基-1-氯丙烷;
(3)根据上面的分析可知,D的结构简式为 CH2=C(CH3)2,E生成碱性水解得F为CH2OHCOH(CH3)2,也为取代反应,
故答案为:CH2=C(CH3)2; 取代反应(水解反应 );
(4)E为CH2BrCBr(CH3)2,E生成碱性水解得F为CH2OHCOH(CH3)2,反应的方程式为CH2BrCBr(CH3)2+2NaOH$→_{△}^{水}$CH2OHCOH(CH3)2+2NaBr,
故答案为:CH2BrCBr(CH3)2+2NaOH$→_{△}^{水}$CH2OHCOH(CH3)2+2NaBr.
点评 本题考查有机物的合成,为高频考点,把握合成流程中碳链变化、官能团变化、有机反应、习题中的信息为解答的关键,侧重分析与推断能力的考查,注意A的分子式及结构的确定,题目难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
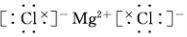 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O2 | B. | C2H4O2 | C. | C3H8O | D. | C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 酚;
酚;  芳香烃;
芳香烃; 酯;
酯;  烯烃.
烯烃.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3L | B. | 2L | C. | 1L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
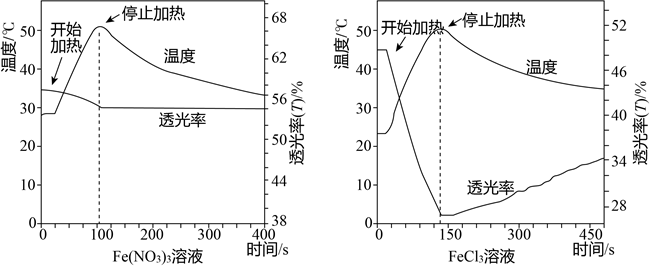
| 编号 | 实验 | 操作及现象 |
| a | 向Fe(NO3)3溶液(棕黄色)中加入大量HNO3 | i.溶液颜色非常浅 ii.加热和降温过程中透光率无明显变化 |
| b | 向FeCl3溶液(黄色)中加入大量HNO3 | i.溶液仍为黄色 ii.加热透光率下降,降温透光率上升 |
| 编号 | 实验 | 操作及现象 |
| c | 向Fe(NO3)3溶液中加入大量HNO3,再加入几滴NaCl溶液. | 测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe3+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L?1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com