
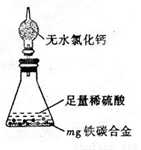
有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。

Ⅰ 探究浓硫酸的某些性质
(1)按图示的 连接装置,检查装置的气密性,称量E的质量。
连接装置,检查装置的气密性,称量E的质量。
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为________。
未点燃酒精灯前,A、B均无明显现象,其原因是: _。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式_______________________(任写一个)。B中的现象是______________,由此可得到浓硫酸具有____________性。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式____________(任写一个)。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是______________________。
Ⅱ 测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式)。
(7)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是___________(填写代号)。
A. 用排水法测定H2的体积
B. 反应 结束后,过滤、洗涤、干燥、称量残渣的质量
结束后,过滤、洗涤、干燥、称量残渣的质量
C. 测定反应前后装置和药品的总质量
科目:高中化学 来源:2016-2017学年山东省高二上期中化学卷(解析版) 题型:选择题
对于达到平衡的可逆反应:X+Y W+Z,增大压强则正、逆反应速率(υ)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是
W+Z,增大压强则正、逆反应速率(υ)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是
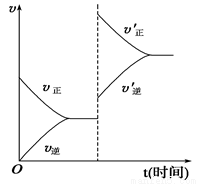
A.Z、W为气体,X、Y中之一为气体
B.Z、W中之一为气体,X、Y为非气体
C.X、Y、Z皆为气体,W为非气体
D.X、Y、Z、W均为气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一12月月考化学卷(解析版) 题型:推断题
A、B、C、D、E五种物质的焰色反应都呈黄色,A、B分别与水反应都有气体放出,同时都生成C溶液,A 与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,C与适量的F气体反应生成D,D溶液与F气体反应生成E,E加热能够生成D、F气体和水。根据以上叙述回答下列问题:
与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,C与适量的F气体反应生成D,D溶液与F气体反应生成E,E加热能够生成D、F气体和水。根据以上叙述回答下列问题:
(1)写出下列物质的化学式:
A__________B__________,C__________,D_________
(2)按要求完成方程式:
①E加热生成D和F的化学方程式_______________________________;
②C溶液和CO2反应生成D的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:选择题
由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )
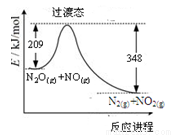
A.断键吸收能量之和大于成键释放能量之和
B.反应物总能量小于生成物总能量
C.N2O(g) +NO(g) =N2(g) +NO2(g)△H= -139kJ/mol
D.反应生成1 mol N2时转移4 mol电子
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上学期12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.78g 由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA
B.密闭容器中2mol NO与1molO2充分反应,产物的分子数为2NA
NO与1molO2充分反应,产物的分子数为2NA
C.5.6g铁与足量盐酸反应转移的电子数为0.3NA
D.标准状况下,2.24 LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
第三周期元素R,它的最外层达到饱和时所需电子数小于次外层和最内层电子数之差,并且等于最内层电子数的正整数倍,则关于R的正确说法
① 常温下能稳定存在的R的氧化物都是酸酐;
② R的气态氢化物都能受热分解;
③ R元素都能以游离态存在于自然界中;
④ R的最高价氧化物对应水化物都是强酸;
⑤ R的氢化物在空气中都能燃烧生成+4价R的氧化物;
⑥ R的单质固态时属于同一类型的晶体。
A. ①③⑥ B. ①②④ C. ①②⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜
B.在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12
C.2 mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2×6.02×1023
D.0.1 mol H2O和D2O组成的混合物中含有的中子数是NA
查看答案和解析>>
科目:高中化学 来源:2016-2017陕西西安长安区一中重点班高一12月考化学卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.相同质量的铝,分别于足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B.56gFe与足量盐酸反应转移电子数为3NA
C.任何条件下,22.4L NH3与18g H2O所含电子数均为10NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:填空题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO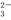 、CO
、CO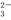 、HSO
、HSO 、HCO
、HCO 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO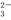
b.2HCOOH+CO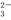 =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO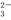
d.Cl2+H2O+2CO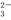 =2HCO
=2HCO +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com