
| A、同种元素的原子均具有相同的质子数和中子数 |
| B、不同元素的原子构成的分子只含极性键 |
| C、第三周期中的非金属元素的气态氢化物还原越强,对应元素的最高价含氧酸酸性越弱 |
| D、第ⅦA族元素从上到下单质及对应的气态氢化物的沸点均逐渐升高 |


科目:高中化学 来源: 题型:
| A、稀有气体原子序数越大,熔点越低 |
| B、同周期元素的原子半径越小,气态氢化物还原性越弱 |
| C、晶体中分子间作用力越强,分子越稳定 |
| D、卤族元素的氢化物,相对分子质量越大,熔沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O(l)→H2O(g) |
| B、2HI(g)→H2(g)+I2(g)+Q Q=-14.9 kJ/mol |
| C、形成化学键时共放出能量862 kJ的化学反应 |
D、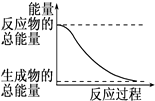 能量变化如图所示的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,Na2O2在这个反应中只做氧化剂 |
| B、C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l);△H=-1367.0kJ/mol(燃烧热) |
| C、过量的NaHCO3溶液与Ca(OH)2溶液反应的离子方程式是:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-→CaCO3↓+H2O |
| B、Fe(OH)3溶于氢碘酸:2Fe(OH)3+6H++2I-→2Fe2++I2+6H2O |
| C、向硫酸铝铵[NH4Al(SO4)2]溶液中加入氢氧化钡溶液至SO42-离子沉淀完全Al3++2SO42-+2Ba2++4OH-→AlO2-+2BaSO4↓+2H2O |
| D、4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合4AlO2-+7H++H2O→3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 投料比 [n(H2):n(CO2)] |
500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com