
某研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取
SO2反应的化学方程式为:Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O,产生的气体通入下图所示装置:
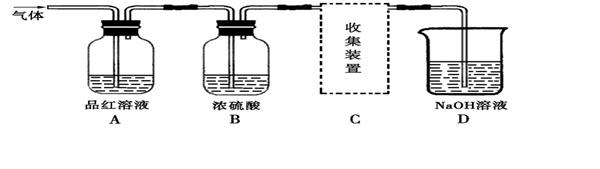
【实验探究】
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为___________L(标准状况,Na2SO3的摩尔质量为126g·mol-1),该制取SO2的反应___________(填“是”或“不是”)氧化还原反应。
(2)A装置观察到的现象是______________,说明SO2具有___________(填“漂白性”或“还原性”)。
(3)B装置中浓硫酸的作用是___________(填“干燥剂”或“氧化剂”)。
(4)D装置的作用是______________________
【实验讨论】
对上图中的C处,甲乙两同学都选用右图装置,但对连接方式持有不同意见。
 甲同学认为:SO2气体应从a处通入集气瓶中。
甲同学认为:SO2气体应从a处通入集气瓶中。
乙同学认为:SO2气体应从b处通入集气瓶中。
你认为___________(填“甲”或“乙”)同学的看法是正确的。
(已知:同等条件下二氧化硫的密度大于空气)
【联系实际】
SO2对环境的影响较大,为了减少SO2对空气的污染,请你提出一种有效的措施________________________ ________________。
科目:高中化学 来源: 题型:
【有机推断与合成】有机物H是一种重要的医药中间体。其结构简式如图所示:
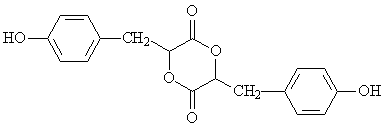
合成H的一种路线如下:
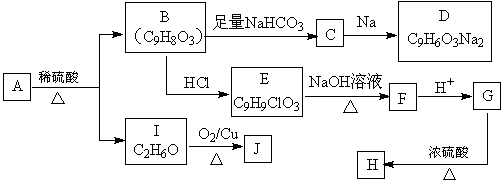
已知以下信息:
①有机物A遇氯化铁溶液发生显色反应,其分子中的苯环上有2个取代基,且A的苯环上一氯代物有2种。
②J能发生银镜反应。
请回答下列问题:
(1)I的名称是 。G生成H的反应类型是 。
(2)B的含氧官能团名称是 ;E生成F的化学方程式为 。
(3)在一定条件下,A与J以物质的量比1∶1反应生成功能高分子材料K,K的结构简式为 。
(4)已知: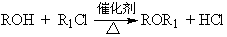
C与E以物质的量比1∶1混合在催化剂、加热条件下反应,写出化学方程式 。
(5)L是B的同分异构体,L符合下列条件的结构有 种(不考虑立体结构)。①与B具有相同的官能团;②遇氯化铁溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、②NaHCO3、③HCl、④NH3·H2O
(1)上述溶液中,可发生水解的是______(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为:____________________________________。
(3)向④中加入少量氯化铵固体,此时c(NH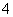 )/c(OH-)的值________(填“增大”、“减小”、或“不变”)。
)/c(OH-)的值________(填“增大”、“减小”、或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是____________ ______________________________________。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化合物的性质如下:①加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体;②溶于水,加入硝酸钡溶液,产生能溶于稀硝酸的白色沉淀。则该物质是
A.NH4Cl B.(NH4)2CO3 C.NaCl D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
将10 mL NO和NO2的混合气体通入装满水的倒立在水槽中的量筒里,充分反应后,最后剩余6mL气体,则原混合气体中NO的体积为
A、1mL B、4mL C、5mL D、7mL
查看答案和解析>>
科目:高中化学 来源: 题型:
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体的说法错误的是( )
A.该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表可以划分为5个区,下列有关说法正确的是( )
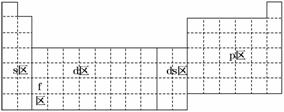
A.s区全部是金属元素
B.p区全部是非金属元素
C.d区内元素原子的价电子排布必为(n-1)d1~10ns2
D.除ds区外,以最后填入电子的轨道能级符号作为区的符号
查看答案和解析>>
科目:高中化学 来源: 题型:
沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=________mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是__________________________________________________。
(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5 mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol·L-1。
(3)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:
__________________________________________________;
②请分析CaSO4转化为CaCO3的原理:_________________________________________
__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com