
短周期主族元素X、Y、Z、W的原子序数依次递减,四种元素中没有同族元素,其原子的最外层电子数之和为15, W与X、Y、Z位于相邻周期,X原子的最外层电子数是W原子内层电子总数的3倍,单质Z可与水剧烈反应,Y、Z均为金属元素。下列叙述正确的是
A. 原子半径:Y>Z
B. 单质熔点:W>X
C. X、Y的氧化物均能与Z的氧化物对应的水化物反应
D. X、W的最简单氢化物的水溶液均显酸性
科目:高中化学 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:填空题
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
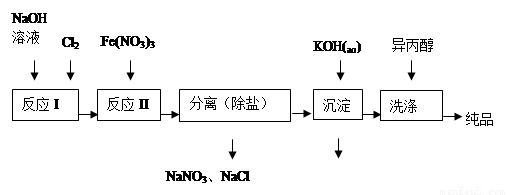
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
对于1LH2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol·L-1,则理论上最多能溶解铜的物质的量为
A. 0.80mol 0.72mol B. 0.45mol C. 0.40mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 由H原子形成1 mol H—H键要吸收能量
B. 所有燃烧的反应都是放热反应
C. 铝条与盐酸的反应是吸热反应
D. 凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:简答题
尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g)  2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体的化学方程式为_______________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s) 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol • L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图所示。
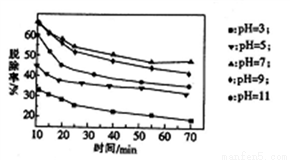
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
(2)脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是___________(任写一点)。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:简答题
硒(Se),是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se原子的核外电子排布式为____________。
(2) 比较As的第一电离能比Se______(填“大”或“小”)。
(3) SeO42-中Se-O的键角比SeO3的键角____(填“大”或“小”)原因是______________
(4) H2SeO4比H2SeO3水溶液的酸性___________。
(5) 硒单质是红色或灰色粉末,带灰色金属光泽的准金属,灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
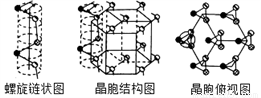
螺旋链中Se原子的杂化方式为__________。己知正六棱柱的边长为acm,高为b cm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的Se原子个数为_________,该晶体的密度为___________g/cm3 (用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y和Z的原子序数依次增大。元素W是形成化合物数量众多,且分布极广的元素,X原子的最外层电子数是其电子层数的3倍,元素Y是地壳中含量最丰富的金属元素,Z元素的单质易溶于WZ2中。下列说法错误的是( )
A. 元素X、Y与Z的原子半径大小:Y>Z>X
B. 元素W、Z的氯化物中,化学键类型相同,且各原子均满足8电子
C. 元素X与元素Y形成的化合物是一种较好的耐火材料
D. 元素X可与元素Z可组成3种二价阴离子
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:简答题
Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如下:
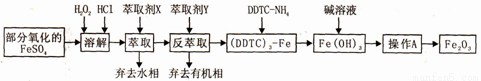
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
② 3DDTC-NH4+Fe3+= (DDTC) 3-Fe↓+3NH4+
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是____________。
A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图用力振摇

D.振摇几次后需打开分液漏斗上口的玻璃塞放气
E.经几次振摇并放气后,手持分液漏斗静置待液体分层
F.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是_______________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
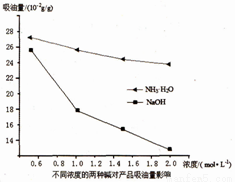
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为_________________。
(4)操作A为______________________。
(5)现准确称取4.000g , 样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80mL。
① 用移液管从容量瓶中吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为_____。
② 产品中铁的含量为_______(假设杂质不与K2Cr2O7反应)。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省大庆市高三第二次教学质量检测(二模)理科综合化学试卷(解析版) 题型:选择题
下列关于有机化合物的叙述符合事实的是
A. 乙烯使溴水和酸性高锰酸钾溶液褪色的反应都属于氧化反应
B. 乙酸和乙醇均能与NaOH溶液发生反应
C. 苯与溴水混合后加入FeBr3做催化剂,可发生取代反应生成溴苯
D. C5H11Br有8种同分异构体,它们的熔点、沸点各不相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com