
【题目】下列物质用作制取光导纤维的原料的是 ( )
A. 单质硅B. 二氧化硅C. 硅酸钠D. 镁铝合金
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是( )
A.NaH与重水反应的方程式:NaH+D2O=NaOH+D2↑
B.三氟化氮的电子式: ![]()
C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4﹣
D.羟基乙酸(HOCH2COOH)的缩聚物: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂.某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O.回答下列问题:
①上述反应体系中化学反应方程式为;
②膦(PH3)能和水发生微弱的化学反应,其水溶液呈弱碱性,该反应可用离子方程式表示为 .
(2)生活污水中含大量细小的悬浮物,可加某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 .
(3)用CH4催化还原NOX可以消除氮氧化物的污染.例如
CH4(g)+4NO2(g) 4NO(g)+CO2 (g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2 , 整个过程中放出的热量为867kJ,则△H2= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。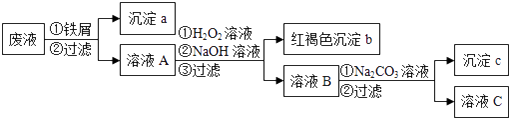
请回答:
(1)沉淀a中含有的单质是;
(2)沉淀b的化学式是;
(3)沉淀c的化学式是;
(4)溶液A与H2O2溶液在酸性条件下反应的离子方程式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于氯化钠晶体,下列描述正确的是( )
A.它是六方紧密堆积的一个例子
B.58.5g氯化钠晶体中约含6.02×1023个NaCl分子
C.与氯化铯晶体结构相同
D.每个Na+与6个Cl-作为近邻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)写出该反应的热化学方程式: .
(2)已知H2O(l)═H2O(g);△H=+44kJmol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是kJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 .
(4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJmol﹣1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=﹣534kJmol﹣1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的是( )
A.用分液漏斗从食醋中分离出乙酸
B.用焰色反应鉴别Na2SO4和Na2CO3
C.用NaOH溶液除去Cl2中含有的少量HCl
D.用KSCN溶液检验FeCl3溶液 中是否含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化,其晶胞结构如图所示。 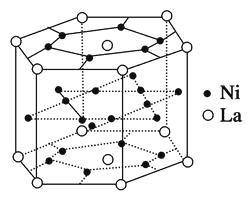
它的化学式为。
②镁系合金是最早问世的合金之一,经X射线衍射实验分析得镁铜合金为面心立方结构,镁镍合金为六方最密堆积。镁系合金的优点是价格较低,缺点是要加热到250℃以上时才释放出氢气。下列有关说法不正确的是
A.金属铜的晶胞结构为 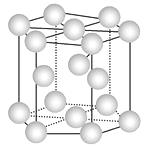
B.已知钛和镁的堆积方式相同,均为六方最密堆积,则其堆积方式为 
C.镁铜合金晶体的原子空间利用率为74%
D.镁镍合金晶体的配位数为12
③《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如图。下列有关说法正确的是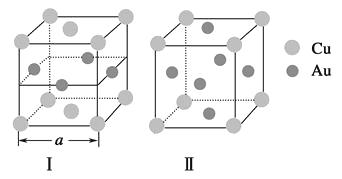
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的边长为acm,则图Ⅰ中合金的密度为 ![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】存在于自然界的植物中,其K1=5.4×10﹣2 , K2=5.4×10﹣5 . 草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.请回答下列问题: 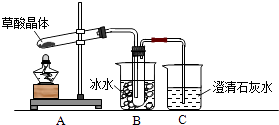
(1)甲组同学按照图1所示装置,通过实验检验草酸晶体的分解产物.装置C中可观察到的现象是 , 由此可知草酸晶体分解的产物中有 . 装置B的主要作用是 .
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验. 
① 乙组同学的实验装置中,依次连接的合理顺序为A、B、 . 装置H反应管中盛有的物质是 .
②能证明草酸晶体分解产物中有CO的现象是 .
(3)设计实验证明: ①草酸的酸性比碳酸的强 .
②草酸为二元酸 .
(4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4溶液、MnO2氧化,锰元素被还原为+2价.KMnO4溶液和草酸钠溶液在稀硫酸中反应的离子方程式为: . 实验室常用固体草酸钠测定KMnO4溶液的浓度.准确称取0.2000g草酸钠,放入锥形瓶中,加入100mL稀硫酸溶解,用配制好的KMnO4溶液滴定,三次重复实验消耗KMnO4溶液的体积分别是16.02mL、16.00mL、16.01mL,则KMnO4溶液的物质的量浓度的计算式是:c(KMnO4)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com