
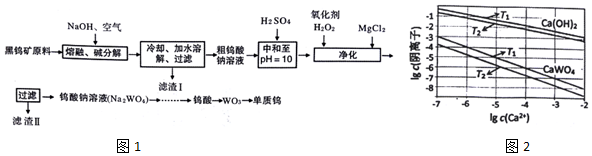
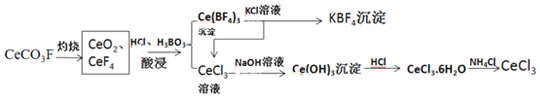
分析 由黑钨矿冶炼钨的工艺流程:向黑钨矿中(主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物)中加入氧气和氢氧化钠,主要反应为:2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O,4FeWO4+O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+4Na2WO4+4H2O,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,钨酸锰和氢氧化钠反应生成钨酸钠和二氧化锰,Si、As生成相应的盐,水浸时,氧化铁和二氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液主要含钨酸钠,滤渣I的主要成份是Fe2O3、MnO2,钨酸钠和浓硫酸反应生成钨酸和硫酸钠;加入过氧化氢,HAsO32-氧化为HAsO42-,加入氯化镁,生成难溶于水的MgSiO3、MgHAsO4,过滤,滤渣Ⅱ为:MgSiO3、MgHAsO4,滤液为钨酸钠,酸化,加热分解产生三氧化钨和水,用还原剂还原三氧化钨生成钨,据此分析解答.
解答 解:(1)钨酸盐(FeWO4、MnWO4)中铁元素、锰元素化合价为+2价,氧元素-2价,化合物中化合价代数和为0,则钨元素的化合价为+6;黑钨矿的主要成分是铁和锰的钨酸盐,根据流程图的提示知,黑钨矿在空气中熔融生成WO42-、MnO2,、Fe2O3等,化学反应方程式为2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O,4FeWO4+O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+4Na2WO4+4H2O;
故答案为:+6;4FeWO4+O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+4Na2WO4+4H2O;
(2)加入过氧化氢,HAsO32-氧化为HAsO42-,离子方程式为:H2O2+HAsO32-═HAsO42-+H2O,加入氯化镁,生成难溶于水的MgSiO3、MgHAsO4,过滤,滤渣Ⅱ为:MgSiO3、MgHAsO4;
故答案为:H2O2+HAsO32-═HAsO42-+H2O;MgSiO3、MgHAsO4;
(3)①根据图象可知,氢氧化钙和钨酸钙(CaWO4)在钙离子浓度相同时,T1温度下阴离子浓度大于T2,说明T1时的溶度积大于T2,溶度积越大,则溶解度越大,所以T1时溶解度较大,由于“已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小”,则T1<T2,T1时KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,
故答案为:<;1×10-10;
②将钨酸钠溶液加入石灰乳,发生复分解反应,氢氧化钙和钨酸根离子反应生成钨酸钙沉淀,反应的离子方程式为:WO42-+Ca(OH)2=CaWO4+2OH-;
故答案为:WO42-+Ca(OH)2=CaWO4+2OH-.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 除去蛋白质中混有的(NH4)2SO4 | 将混合物装入半透明袋,并放入流动的蒸馏水中 |
| B | 除去Mg粉中混有Al粉 | 加入足量NaOH溶液,过滤、洗涤、干燥 |
| C | 用苯萃取溴水中的Br2 | 先从分液漏斗下口放出水层,再从上口倒出有机层 |
| D | 测定NaClO溶液中的pH | 用玻璃棒蘸取溶液点滴在pH试纸上,与标准比色卡对照 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式: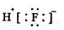 | |
| B. | S2-结构示意图: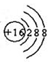 | |
| C. | 异丁烷的结构简式:CH3CH2CH2CH3 | |
| D. | 硝酸钙的电离方程式:Ca(NO3)2=Ca2++(NO3)22- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | Si3N4 | Al(OH)3 | Si | Fe2O3 |
| 用途 | 制造汽车发动机 | 抗酸药 | 光导纤维 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C9H11O5 | |
| B. | 可以分别与乙醇、乙酸在一定条件下反应,且反应类型相同 | |
| C. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 | |
| D. | 含有苯环的酯的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将FeCl3饱和溶液滴入一定量的沸水中红褐色透明液体,用激光笔照射 | 有丁达尔效应 | 红褐色液体为胶体 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰为黄色 | 原溶液中有Na+、无K+ |
| C | 将气体X分别通入品红溶液和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是乙烯 |
| D | 向溶液Y中滴加硝酸,再滴加BaCl2溶液 | 有白色沉淀生成 | Y中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀. | 淀粉己完全水解 |
| B | 向浓度均为0.1mol•L-1的Na2CO3和Na2S的混合溶液中,滴入少量AgNO3溶液,先产生黑色沉淀(Ag2S). | Ksp(Ag2S)<Ksp(Ag2CO3) |
| C | 向溶液X中先滴加稀硝酸,再滴加BaCl2溶液,出现白色沉淀. | 溶液X中一定含有SO42- |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色. | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能与溴的四氯化碳溶液反应使溶液褪色 | |
| B. | 用浸泡过高锰酸钾溶液的硅土保鲜水果 | |
| C. | 无论乙烯还是甲苯,都能使酸性高锰酸钾溶液褪色,这与它们分子内含有碳碳双键有关 | |
| D. | 石油的分馏是物理变化而煤的干馏是化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com