
海底蕴藏着大量的“可燃冰”.用甲烷制水煤气(CO、H2),再合成甲醇来代替日益供应紧张的燃油.
已知:
①CH4(g)+H2O(g)=CO(g)+3H2(g)△H1=+206.2kJ•mol﹣1
②CH4(g)+O2(g)=CO(g)+2H2(g)△H2=﹣35.4kJ•mol﹣1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H3=+165.0kJ•mol﹣1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为 .
(2)从原料、能源利用的角度,分析反应②作为合成甲醇更适宜方法的原因是 .
(3)水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:[Cu(NH3)2]Ac+CO+NH3⇌[Cu(NH3)3]Ac•CO△H<0,[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是 .
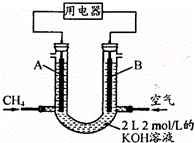
(4)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性石墨棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为 .
②44.8L<V≤89.6L时,负极电极反应为 .
③V=67.2L时,溶液中离子浓度大小关系为 .
| 用盖斯定律进行有关反应热的计算;常见化学电源的种类及其工作原理;化学平衡的调控作用.. | |
| 专题: | 基本概念与基本理论. |
| 分析: | (1)根据盖斯定律结合已知热化学方程式分析; (2)从能量角度和原子利用率角度两个方面分析; (3)已知正反应是气体物质体积减小的放热反应,据此分析; (4)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应. |
| 解答: | 解:(1)根据盖斯定律可知,①×2﹣③可得CH4(g)+CO2(g)=2CO(g)+2H2(g),所以其△H=[(+206.2)×2﹣(+165.0)]kJ•mol﹣1=+247.4 kJ•mol﹣1,所以CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJ•mol﹣1, 故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJ•mol﹣1; (2)从能量角度比较,①是吸热反应,需要消耗更多能量,②是放热反应,不需要太多能量;从原子利用率角度,由于CO+2H2→CH3OH,①的产物中氢原子不可能全部变为CH3OH,而②的产物中所有原子都可能全部变为CH3OH;因此选②,甲烷不完全燃烧制合成气时放出热量,还得到物质的量之比为1:2的CO和H2的混合气体,能恰好完全反应生成甲醇, 故答案为:选择CH4不完全燃烧制合成气时,放出热量,同时得到的CO、H2物质的量之比为1:2,能恰好完全反应合成甲醇,符合绿色化学的“原子经济”原则; (3)已知正反应是气态物质体积减小的放热反应,因此采用降低温度、增大压强能使平衡右移,提高CO的转化率,故答案为:低温、高压; (4)n(KOH)=2mol/L×2L=4mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3; ①当0<V≤44.8 L时,0<n(CH4)≤2mol,则0<n(CO2)≤2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O, 故答案为:CH4+2O2+2KOH=K2CO3+3H2O; ②当44.8 L<V≤89.6 L,2mol<n(CH4)≤4mol,则2mol<n(CO2)≤4mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4﹣8e﹣+9CO32﹣+3H2O=10HCO3﹣, 故答案为:CH4﹣8e﹣+9CO32﹣+3H2O=10HCO3﹣; ③当V=67.2 L时,n(CH4)=3mol,n(CO2)=3mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到1molK2CO3和2molKHCO3的溶液,则c(K+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+), 故答案为:c(K+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+). |
| 点评: | 本题考查了运用盖斯定律计算焓变、热化学方程式的书写、评价物质合成方案、影响化学平衡的因素、燃料电池、溶液中离子浓度大小关系等重要考点,涉及的知识点较多,综合性较强,难度较大. |


科目:高中化学 来源: 题型:
海水是一个非常丰富的化学资源,以海水为原料可制取Mg、氯气、Br2、碘等。
(1)写出镁在二氧化碳中燃烧的化学方程式:________________________________。
(2)下列有关海水综合利用的说法正确的是________。
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备镁
D.从海带中提取碘单质的过程不涉及氧化还原反应
(3)液溴呈________色,提取单质溴时常将氯气通入苦卤(海水晒盐后得到的母液)中,将其中的溴离子氧化,反应的离子方程式为________________________,
(4)加碘食盐中的含碘物质是________,碘加热时变成紫色的碘蒸气,这一过程叫________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由阿伏加德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有( )
A.1摩尔水的质量 B.1摩尔水蒸气的质量
C.1摩尔水的体积 D.1摩尔水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl﹣、Br﹣、SO42﹣、HCO3﹣、CO32﹣等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示:下列说法错误的是( )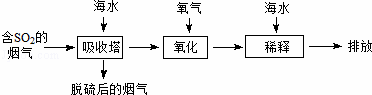
|
| A. | 海水pH约为8的原因主要是天然海水含CO32﹣、HCO3﹣ |
|
| B. | 吸收塔中发生的反应有SO2+H2O⇌H2SO3 |
|
| C. | 氧化主要是氧气将HSO3﹣、SO32﹣、H2SO3氧化为SO42﹣ |
|
| D. | 经稀释“排放”出的废水中,SO42﹣浓度与海水相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释实验事实的方程式不正确的是( )
|
| A. | 葡萄糖的酯化反应若用浓硫酸作催化剂会炭化发黑:C6H12O6(葡萄糖) |
|
| B. | 向AgNO3溶液中加入过量Na2S溶液后,再加NaCl稀溶液,黑色沉淀变成白色:Ag2S+2Cl﹣=2AgCl↓+S2﹣ |
|
| C. | 将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O⇌NH3•H2O⇌NH4++OH﹣ |
|
| D. | 明矾的水溶液pH<7:Al3++3H2O⇌Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化必须加入氧化剂才能实现的是
A.Cr2O72- → CrO42- B.HNO3 → NO2
C.SiO2 → Si D.CH3CH2OH → CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列有关两种溶液的说法不正确的是
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01 mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A+B═3C+4D反应中,下面表示的化学反应速率最快的是
A.v(A)=0.5mol/(L•min) B.v(B)=0.05mol/(L•min)
C.v(C)=0.9mol/(L•min) D.v(D)=1.0mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容的密闭容器中,可逆反应X(s)+3Y(g)  2Z(g);ΔH>0,达到平衡时,下列说法正确的是( )
2Z(g);ΔH>0,达到平衡时,下列说法正确的是( )
A.充入少量He使容器内压强增大,平衡向正反应方向移动
B.升高温度,平衡向正反应方向移动,平均分子量变小
C.继续加入少量X,X的转化率减小,Y的转化率增大
D.继续加入少量Y,再次平衡时,Y的体积分数比上次平衡小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com