
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
科目:高中化学 来源: 题型:解答题
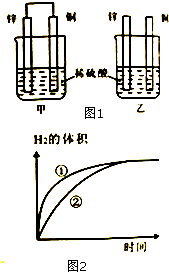 将锌片和铜片按如图1所示方式插入100mL相同浓度的稀硫酸中,某化学兴趣小组探究化学能与电能的相互转化,回答:
将锌片和铜片按如图1所示方式插入100mL相同浓度的稀硫酸中,某化学兴趣小组探究化学能与电能的相互转化,回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
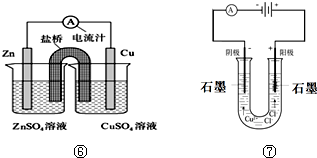
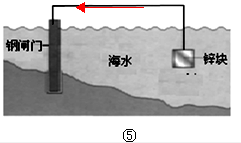 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3.H2O=Al(OH)3↓+3NH4+ | |
| B. | 碳酸钙和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- | |
| D. | 铜加入稀硝酸中:Cu+4H++NO3-=Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+═2Fe2++S↓ | |
| D. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O═CH3COO-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
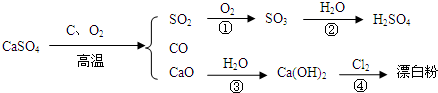
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研究有机物一般要经过的基本步骤是:确定实验式→确定分子式→确定结构式→分离、提纯 | |
| B. | 石油的分馏、裂化、裂解和煤的干馏、液化、气化都是物理变化 | |
| C. | “三大合成材料”一般是指塑料、合成纤维、合成橡胶 | |
| D. | 糖类、油脂、蛋白质并不都是高分子化合物,但都可以在一定条件下发生水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com