
| 实验操作和现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL 浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
| D | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶液中的反应符合强酸反应制弱酸;
B.浓硫酸稀释放热;
C.乙醇含有羟基,可与钠反应;
D.NaOH溶液过量,发生沉淀的生成,无法判断氢氧化镁与氢氧化铁的溶解度大小.
解答 解:A.强酸反应制弱酸,NaHCO3溶液只与CH3COOH反应,酸性:CH3COOH>H2CO3>H3BO3,故A正确;
B.浓硫酸稀释放热,温度升高,反应速率加快,不仅仅时浓度的影响,故B错误;
C.钠能与乙醇中的羟基反应生成氢气,与电离无关,故C错误;
D.向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,NaOH溶液过量,发生沉淀的生成,而不发生沉淀的转化,则不能比较溶度积大小,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较、沉淀的生成及转化、电解质判断、影响反应速率的因素等,侧重化学反应原理及实验分析能力的考查,注意实验的评价性、操作性分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 操作及预期现象 | 结论 | |
| A | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| B | 向某无色溶液滴加硝酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | A1箔插入稀HNO3中,无现象 | A1箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色 | 原溶液中有Na+无K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
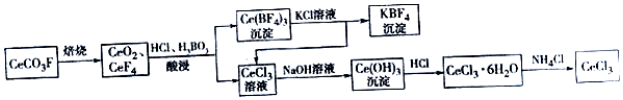
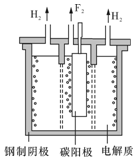
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
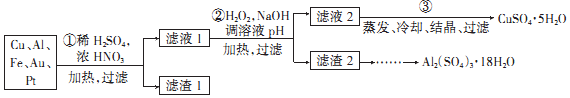
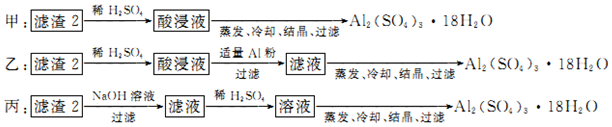
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ④⑤⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和反应反应热实验中,为了充分反应,应将NaOH溶液缓缓倒入盐酸中 | |
| B. | 配制FeCl3溶液时,将FeCl3,晶体溶解在较浓的盐酸中,再加蒸馏水稀释到所需浓度 | |
| C. | 用盐酸滴定NaOH溶液时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛注视滴定管内液面 | |
| D. | 检验Fe(NOs)2晶体是否变质时,将Fe(NO3)2样品溶于稀H2SO4后,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O | |
| B. | 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+Fe2+ | |
| C. | 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-=Al2(CO3)3↓ | |
| D. | 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=NO3-+NO2-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com