
二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行判断,其中正确的是( )
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C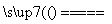 Si+2CO↑
Si+2CO↑
③SiO2+4HF===SiF4↑+2H2O
④Na2CO3+SiO2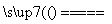 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C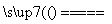 SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃
b.反应②中SiO2表现出氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④符合用难挥发性的酸酐制取易挥发性酸酐的道理
e.反应⑤中SiO2未参加氧化还原反应
A.ace B.bde C.cde D.ab
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部( )
(2)振荡分液漏斗时应关闭其玻璃塞和活塞( )
(3)取用固体药品一定要用镊子夹取( )
(4)长时间盛放石灰水的烧杯应先加入适量的盐酸进行洗涤( )
(5)用氢氟酸清洗做过硅酸分解实验的瓷坩埚( )
(6)用湿润的蓝色石蕊试纸检验NH3( )
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了如下实验测量m g铜银合金样品中铜的质量分数:
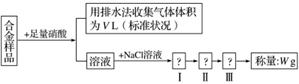
下列说法中不正确的是( )
A.合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性
B.铜银都能与稀硝酸反应,收集到的V L气体一定全为NO
C.操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ是烘干
D.根据反应收集到的气体体积可以计算铜和银的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物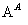 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物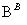 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐。
该小组同学利用下图装置进行实验(部分夹持仪器略)。
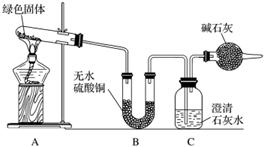
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是_______________________________________________。
(2)加热后试管中剩余的黑色物质是___________________________________________。
(3)假设该绿色物质是一种纯净物,则其化学式可能是________________________,加热分解的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(4)上述实验步骤③中的反应的离子方程式为_______________________________
________________________________________________________________________。
(5)实验装置最后的干燥管的作用是__________________________________。
(6)如果将B、C两装置对调,能否达到实验目的______(填“能”或“不能”),为什么?________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
A.青石棉是一种硅酸盐材料
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1 mol青石棉能使1 mol HNO3被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)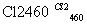 SiCl4
SiCl4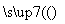 SiCl4(纯)
SiCl4(纯)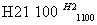 Si(纯)
Si(纯)
写出SiCl4的电子式:______________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com