
| A. | K+、Na+、MnO4-、SO42- | |
| B. | I-、Na+、NO3-、ClO- | |
| C. | Mg2+、Na+、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ |
分析 A.无色溶液中不存在有色的高锰酸根离子;
B.次氯酸根离子能够氧化碘离子;
C.四种离子之间不反应,都是无色离子;
D.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子、铵根离子与氢氧根离子反应,碳酸氢根离子与氢离子反应.
解答 解:A.MnO4-为有色离子,在溶液中不能大量共存,故A错误;
B.I-、ClO-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Mg2+、Na+、NO3-、SO42-之间不反应,都是无色离子,在溶液中不能大量共存,故C正确;
D.加入Al能放出H2的溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意溶液的具体反应条件,“加入铝粉产生氢气”的溶液中存在大量氢离子或氢氧根离子.


科目:高中化学 来源: 题型:选择题
| A. | 反应速率:乙>甲 | |
| B. | 平衡混合物中SO2的体积分数:乙>甲 | |
| C. | SO2的转化率:乙>甲 | |
| D. | 平衡时O2的体积分数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 9.1% | C. | 1% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 小于0.6 mol | ||
| C. | 大于0.6 mol | D. | 大于0.3 mol,小于0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只能得电子被还原,阴离子只能失电子被氧化 | |
| B. | 已知①Fe+Cu2+═Fe2++Cu;②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ | |
| C. | 化学反应中,得电子越多的氧化剂,其氧化性就越强 | |
| D. | 已知还原性:B->C->D-,反应 2C-+D2═2D-+C2 和反应 2C-+B2═2B-+C2 都能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
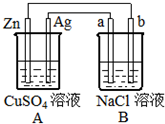 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通直流电后,溶液中溶质分子分别向两极移动,而胶体中分散质粒子向某一极移动 | |
| B. | 向Fe(OH)3胶体中不断滴加稀硫酸,最终胶体聚沉产生红褐色沉淀 | |
| C. | 硫酸铜溶液通过一束光无特殊现象,淀粉溶液中通过一束光侧面出现一条光亮的通路 | |
| D. | 溶液中溶质粒子的运动有规律,胶体粒子运动无规则 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com