
【题目】石膏转化为硫酸钾和CaCl2的工艺流程如图:

![]()
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是___(用化学方程式表示)。
(2)过滤Ⅰ得到的滤液是___,检验滤液中含有CO32-的方法__。
(3)转化Ⅱ中发生反应的化学方程式为___,转化Ⅱ中可获得K2SO4的原因是__。
(4)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是___。
a.熔点较低(29℃熔化) b.能制冷
c.无毒 d.能导电
(5)废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。而电解法产生的强氧化物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性溶液来模拟。阳极的电极反应式___,处理1mol(NH4)2SO4,需要消耗HClO物质的量是___mol。
【答案】CaCO3![]() CaO+CO2↑ (NH4)2SO4 取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同 a c H2O+Cl—2e-=HClO+H+ 3mol
CaO+CO2↑ (NH4)2SO4 取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- 2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同 a c H2O+Cl—2e-=HClO+H+ 3mol
【解析】
碳酸铵和硫酸钙反应生成硫酸铵和碳酸钙,将碳酸钙过滤后溶液中加入氯化钾,得到硫酸钾固体,再过滤,溶液为氯化铵,加入氧化钙和水,得到氨气和氯化钙。
(1)工业上用煅烧石灰石的方法得到二氧化碳,反应方程式为: CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(2)碳酸铵和硫酸钙反应生成碳酸钙沉淀和硫酸铵,所以过滤后的滤液为 (NH4)2SO4 ;
利用碳酸根离子能和酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊进行实验,实验操作为:取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32- ;
(3).从流程分析,加入氯化钾,析出硫酸钾,所以反应方程式为:2KCl+(NH4)2SO4=K2SO4↓+2NH4Cl;因为 KCl、(NH4)2SO4、K2SO4、NH4Cl四种物质的溶解度受温度的影响不同,所以硫酸钾随着温度变化较大,能控制温度变化使其析出;
(4)储热材料说明可以吸收热量,这说明化合物的熔点较低,易吸热熔化,从而可以降低周围环境的温度,同时化合物应该是无毒的,对人体健康没有伤害。故选a、c;
(5)根据题中信息,氯离子在阳极电子生成次氯酸,故电极反应为H2O+Cl—2e-=HClO+H+,根据化合价分析,铵根离子的氮元素化合价从-3升高到0,次氯酸中的氯元素化合价从+1降低到-1,根据得失电子数相等分析,硫酸铵和次氯酸的比例为1:3,故处理1mol(NH4)2SO4,需要消耗HClO物质的量是3mol。


科目:高中化学 来源: 题型:
【题目】现有五种元素,其中A、B、C为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C原子第一至第四电离能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
F是前四周期中电负性最小的元素 |
G在周期表的第八列 |
(1)已知BA5为离子化合物,写出其电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈____形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为![]() ,该同学所画的电子排布图违背了___________________________________。
,该同学所画的电子排布图违背了___________________________________。
(4)G位于第____族____区,该元素的核外电子排布式为_____________________。该二价离子很容易被氧化成三价离子,从原子轨道理论解释原因________________________
(5)检验F元素的方法是___,请用原子结构的知识解释产生此现象的原因: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是短周期主族元素,原子序数依次增大。它们的部分信息如下表所示:
A | B | C | D | E | F | G | |
原子半径/nm | 0.077 | 0.074 | 0.186 | 0.143 | 0.099 | ||
主要化合价 | -4,+4 | -2 | +3 | -4,+4 | -1,+7 | ||
其它 | 阳离子核外无电子 | 它的化合物数量众多分布极广 | 焰色反应呈黄色 | 无机非金属材料的主角 |
(1)F在元素周期表中的位置是____________;
(2)任写一个BA4的同系物的分子式___________;
(3)请用电子式表示DG的形成过程____________;
(4)元素D与C按原子个数比1∶1形成的化合物所含的化学键有______(填化学键类型);
(5)D与E相比,金属性较强的是_____(用元素符号表示),元素D、E最高价的氧化物对应的水化物反应的离子方程式为___________
(6)工业上冶炼单质E的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸是苹果醋中的主要酸性物质。下面是以化合物(Ⅰ)为原料合成苹果酸(Ⅳ)的合成路线。

回答下列问题:
(1)化合物Ⅰ生成化合物Ⅱ的反应原子利用率可达100%,化合物Ⅰ的结构简式为__________________。
(2)苹果酸分子中所含官能团的名称是_____________________________________。
(3)写出上述流程中化合物Ⅱ转化成化合物Ⅲ的反应条件:____________________。
(4)化合物Ⅰ有多种同分异构体,其中与化合物Ⅰ官能团种类相同且只有一个甲基的共有 ____种(不包括化合物Ⅰ)。
(5)上述合成路线中涉及的反应类型有____________________________。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应 e.还原反应
(6)写出苹果酸分子与足量金属钠反应的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,两个常见的固氮反应的平衡常数的对数值(lgK)与温度的关系如图所示:①N2+3H22NH3 ②N2+O22NO;根据图中的数据判断下列说法正确的是( )

A.反应①和②均为放热反应
B.升高温度,反应①的反应速率减小
C.在1000℃时,反应①和反应②体系中N2的浓度一定相等
D.在标准状况下,利用反应①固氮和利用反应②固氮反应程度相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初中化学常见物质A-I分别是下列物质中的一种:锌、氢氧化钠、硫酸铜溶液、稀盐酸、碳酸钠溶液、石灰水、生石灰、石灰石和水。他们之间相互的反应(每种物质只能用一次)恰好包含了化合反应(A+B)、分解反应(C)、置换反应(D+E)、中和反应(F+G)、复分解反应(H+I)等反应类型。试回答下列问题:
(1)A+B的反应化学方程式是______________________。
(2)C的化学式为___________;硫酸铜溶液参加___________反应(填反应类型)。
(3)H+I的反应方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质](1)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如图所示)中羧基氧原子的轨道杂化类型分别是______________
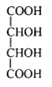
(2)氰酸(HOCN)的结构式是_________,根据等电子体原理,可推测氰酸根离子的空间构型是____。

(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为_____________.
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键.二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种.
①二茂铁的分子式为__________.
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷.因此每个环含有________个π电子.
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8~20kJ/mol.温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c.比较稳定的是__________结构(填“重叠”或“错位”).
(5)氧化镍(NiO)是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。基态Ni2+有_________个未成对电子,已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 ____________m2/g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )

A.原子半径: Y >Z >X
B.元素气态氢化物的热稳定性:X < Z
C.Y和Z的最高价氧化物对应水化物均为强酸
D.X的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下,56g丙烯与环丁烷的混合气体中含有4NA个碳原子
B. 25℃,pH=1的H2SO4溶液中,H+的数目为0.2NA
C. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
D. 1mol的P4O6中含有6 NA个P-O键(P4O6的结构如图: ![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com