
分析 根据混合气体的总体积以及各成分所占的百分含量确定各自的体积以及物质的量,根据热化学方程式的意义来计算一定物质的量的气体燃烧放出的热量.
解答 解:根据题意,各个气体的百分含量:H2 50%、CH4 30%、CO 10%,所以1M3(1000L)混合气体中,含有氢气的体积是500L,即标况下$\frac{500L}{22.4L/mol}$=$\frac{500}{22.4}$mol,含有甲烷的体积是300L,物质的量是$\frac{300}{22.4}$mol,一氧化碳的体积是100L,物质的量是$\frac{100}{22.4}$mol,根据热化学方程式系数和能量之间的正比例关系,所以该种煤气燃烧时放出的热量为:285.8kJ×$\frac{500}{22.4}$+282.6kJ×$\frac{100}{22.4}$+$\frac{300}{22.4}$×890.3kJ≈19564.73kJ,
答:燃烧1M3(标准状况)的煤气时放出的热量为19564.73kJ.
点评 本题考查热化学方程式的系数和能量之间的关系知识,注意知识的归纳和整理是解题的关键,题目难度不大.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| B. | 垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能 | |
| C. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 | |
| D. | 燃料电池是一种高效、环境友好的发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入1molCl2:2Fe2++2Br-+2Cl2→4Cl-+Br2+2Fe3+ | |
| B. | 通入足量Cl2:2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl- | |
| C. | 加入含2molBa(OH)2的溶液:Al3++SO42-+Ba2++4OH-→BaSO4↓+AlO2-+2H2O | |
| D. | 加入足量Ba(OH)2的溶液:Fe2++Al3++SO42-+Ba2++6OH-→Fe(OH)2↓+AlO2-+BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 ;
; ;
;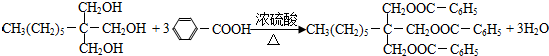 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 点①所示溶液中:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 点③所示溶液中:c(CH3COO-)-c(CH3COOH)=c(Na+)+2c(H+)-2c(OH-) | |
| D. | pH=12的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未用NaOH溶液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向运动,随之消失,溶液变成红色. |
| 2.向新制得的Na2S溶液中滴加少量新制的氯水 | B.有气体产生,溶液变成浅红色 |
| 3.将一小块钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| 4.将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| 5.将铝条投入稀盐酸中 | E.生成淡黄色沉淀 |
| 实验内容 | 实验现象 | 离子方程式 |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 |
| 实验 序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g•g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中第16个纵行表示为ⅥA | |
| B. | ⅦA元素也称为卤族元素 | |
| C. | 元素周期表中,Ⅷ包括第8,9,10纵行 | |
| D. | 0族元素的原子最外层电子数为8,元素化合价为0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com