
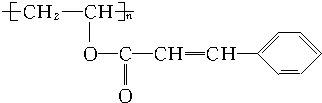
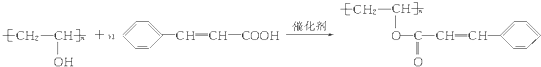
 .
. 科目:高中化学 来源: 题型:填空题
 如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.
如图所示用一起A、B和胶管组成装置收集NO气体(仪器A已经气密性检查;除水外不能选用其他试剂)正确的操作步骤是:在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO气体,水通过b和c排入B中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2Cl | B. | CH3CHBrCH(CH3)CH2Br | ||
| C. | CH3CHBrCH2CH2Br | D. | CH3CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离工业废水,回收废液中的有用成分 | |
| B. | 将化学能转换成电能,将热能转换成电能 | |
| C. | 食品工业中,浓缩天然果汁、乳制品加工和酿酒 | |
| D. | 海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛是甲基跟醛基相连而构成的 | |
| B. | 饱和一元醛的通式可简写为RCOH | |
| C. | 在银镜反应中乙醛体现了氧化性 | |
| D. | 饱和一元脂肪醛的分子组成符合通式CnH2nO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的Ca(ClO)2溶液中含ClO-数目为2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 | |
| D. | 某密闭容器盛有0.1molN2,0.3molH2,在一定条件下反应,转移的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
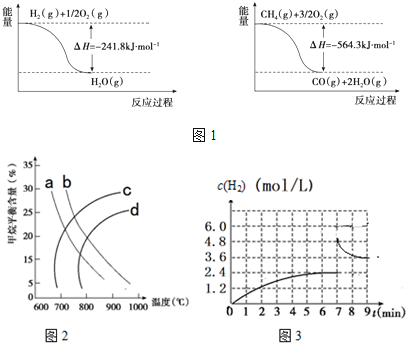
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
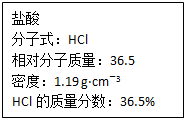 (1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com