
 实验是进行化学研究的重要手段之一.请回答下列问题:
实验是进行化学研究的重要手段之一.请回答下列问题:分析 (1)a试管可以直接加热;
b钠性质活泼,密度大于煤油;
c氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性;
d依据浓硫酸稀释正确顺序;
e氢氧化钠具有腐蚀性,称量应放在小烧杯或者称量瓶中进行;
(2)①依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;
②依据m=CVM计算需要溶质的质量;依据配制一定物质的量浓度溶液的一般步骤排序.
解答 解:(1)a烧杯、量筒、集气瓶均不能用酒精灯直接加热,试管可以直接加热,故a不选;
b钠性质活泼,密度大于煤油,钠保存煤油或石蜡油中可以隔绝空气,故b选;
c湿润的蓝色石蕊试纸放入盛有氯气的集气瓶中,氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,所以最终其颜色褪去,故c选;
d浓硫酸密度大于水,稀释时应将浓硫酸缓缓加入到水中,故d不选;
e氢氧化钠具有腐蚀性,称量应放在小烧杯或者称量瓶中进行,故e不选;
故选:bc;
(2)①配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平(含砝码)、烧杯、玻璃棒、500 mL容量瓶、胶头滴管,用不到的仪器:平底烧瓶和分液漏斗,还缺少的仪器:500ml容量瓶 小烧杯 玻璃棒;
故答案为:AC 500ml容量瓶 小烧杯 玻璃棒;
②需用480mL 0.1mol•L-1标准NaOH溶液,应选择500mL容量瓶,需要溶质的质量m=0.5L×0.1mol/L×40g/mol=2.0g;
配制溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,所以正的顺序为:abdcfe;
故答案为:2.0;abdcfe.
点评 本题考查了配制一定物质的量浓度的溶液的方法,掌握配制一定物质的量浓度的溶液的原理及操作步骤是解题关键,题目难度不大,侧重考查学生基础实验能力.


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:解答题
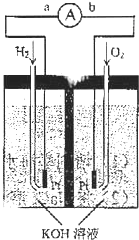 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
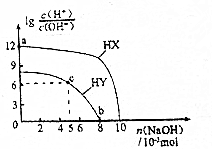
| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12mol•L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2为0.1mol/L | B. | X2为0.2mol/L | C. | Z2为0.3mol/L | D. | Z2为0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙池中CuSO4溶液的浓度不变 | |
| B. | 甲池中理论上消耗标准状况下空气的体积是2.8L(空气中O2体积分数以20%计算) | |
| C. | 甲池是电能转化为化学能的装置,乙池是化学能转化为电能的装置 | |
| D. | 甲池中通入CH3OH一极的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com