
| A. | 酸性:HF>HCl>H2S | B. | 沸点:CBr4>CCl4>CF4 | ||
| C. | 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3 | D. | 稳定性:H2O>H2S>H2Se |
分析 A.HF为弱酸,HCl为强酸;
B.均为分子晶体,相对分子质量越大沸点越高;
C.金属性越强,对应碱的碱性越强;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.酸性为HCl>HF>H2S,故A错误;
B.均为分子晶体,相对分子质量越大沸点越高,则沸点为CBr4>CCl4>CF4,故B正确;
C.金属性越强,对应碱的碱性越强,则碱性为Ca(OH)2>Mg(OH)2>Al(OH)3,故C正确;
D.非金属性越强,对应氢化物越稳定,则稳定性为H2O>H2S>H2Se,故D正确;
故选A.
点评 本题考查元素周期律和周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
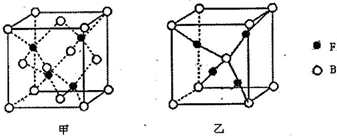
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数等于或大于3(小于8)的元素一定是主族元素 | |
| B. | 元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱 | |
| C. | 在主族元素中,最高正化合价均等于主族序数 | |
| D. | 元素的原子得电子越多,非金属性越强;失电子越多,金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ③⑤ | C. | ②④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
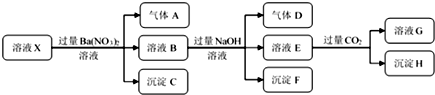
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3,工业上往BaCO3中加入饱和的Na2CO3可以实现BaSO4的转变 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表中,零族元素的单质在常温下全部都是气体 | |
| B. | 同周期元素,ⅦA族的原子半径最大 | |
| C. | ⅥA族元素的原子,其半径越大,越容易失去电子 | |
| D. | 所有主族元素的原子形成单原子离子时的最高化合价数都和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:3:2 | B. | 3:3:1 | C. | 1:2:3 | D. | 1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O=H2CO3和H2CO3=CO2+H2O | |
| B. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑和2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3和2SO3$\frac{\underline{催化剂}}{△}$2SO2+O2 | |
| D. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI和2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2+I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com