
| M(OH)n | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mg(OH)2 | 9.5 | 11.0 |
| Cr(OH)3 | 4.3 | 5.0 |
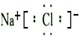 ;与Na,Cl同周期,且简单离子半径最小的离子为Al3+;离子结构示意图为:
;与Na,Cl同周期,且简单离子半径最小的离子为Al3+;离子结构示意图为: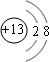 ,故答案为:蒸发结晶;
,故答案为:蒸发结晶; ;
; ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
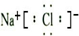
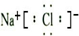
| M(OH)n | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mg(OH)2 | 9.5 | 11.0 |
| Cr(OH)3 | 4.3 | 5.0 |
查看答案和解析>>
科目:高中化学 来源:江西省白鹭洲中学2012届高三第一次月考化学试题 题型:058
海水中不仅含有丰富的非金属元素资源,(如CI,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是:________;与Na,Cl同周期,且简单离子半径最小的离子结构示意图:________.
(2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是:________;(填序号)
①加稀HCl滤液至酸性,②过滤除去杂质,③加过量NaOH溶液,④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥溶解,⑦蒸发结晶;
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体.
有关资料:
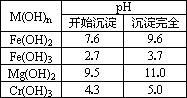
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,则最佳试剂选择和操作是:
①先加________;目的是________;
②再加________;目的是________;
③过滤后,为能得到纯净MgCl2晶体,采用的操作方法是:________;
查看答案和解析>>
科目:高中化学 来源:江西省模拟题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:江西省模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com