
ij��ѧѧϰС�������ͼʵ��װ�ã��г�װ����ȥ���Ʊ�Cl2����̽��������������ʣ�
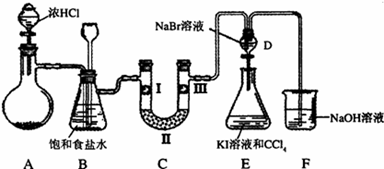
��1����Aװ���й���ҩƷΪMnO2,�仯ѧ����ʽΪ
��Aװ���й���ҩƷΪKClO3����Ӧ��ÿ����1molCl2ʱת�Ƶ��ӵ����ʵ���Ϊ mol��
��2��װ��B�����ã�
��3��װ��C����������֤�����Ƿ����Ư���ԣ�l����ʪ�����ɫ���������Ӧ��������ʷֱ��� ��
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢��ķǽ����ԡ�����ͬѧ��Ϊ����Ʋ������ܣ��������ɿ��� ��
��5�����û�ѧ����ʽ˵��װ��F������ ��
��6����ͬѧ�����װ��F�е��Լ��ɸ��ù�����Na2SO3��Һ����ͬѧ����˼������Ϊ�˷������У��������ӷ���ʽ��������Ϊ�����е�ԭ��
��֪ʶ�㡿��������ȡ������ D2 J1 J3
���𰸽�������1�� MnO2+4HCl(Ũ��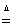 MnCl2 + Cl2��+2H2O (2 �֣� 5/3��2�֣�
MnCl2 + Cl2��+2H2O (2 �֣� 5/3��2�֣�
��2�����ܳ�ȥ�����е��Ȼ��⣬���ܼ��ʵ�������װ��C�Ƿ���������2�֣������1�֣�
��3����ˮ�Ȼ��ƣ��轺��P2O5�����������ɫ����������1�֣���2�֣�
��4����D�����й�������������֤�������ķǽ�����ǿ����2�֣�
��5��Cl2+2NaOH=NaCl+NaClO+H2O����2�֣�
��6��SO32-+Cl2+H2O=SO42-+2Cl-+2H+��SO32-+2H+=SO2��+2H2O ��2�֣�


 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
.����һ�������������MgSO4�Ļ����Һ����μ���Ba(OH)2��Һ����������������m�����Ba(OH)2�����ʵ���n֮��Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. 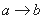 ʱ�ij����ɷ�ΪBaSO4��Mg(OH)2
ʱ�ij����ɷ�ΪBaSO4��Mg(OH)2
B. 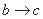 ʱ���������ӷ�ӦΪH++OH-=H2O
ʱ���������ӷ�ӦΪH++OH-=H2O
C. c��ʱ����Һ��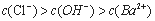
D. ԭ�����Һ�У�n(HCl)=2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijϩ���Ľṹ��ʽΪ
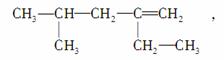
�мס��ҡ���������λͬѧ�ֱ�������Ϊ��2��4�һ�4��ϩ��2�춡��1��ϩ��2,4����3��ϩ��4��2�һ�1��ϩ�������4λͬѧ�������ж���ȷ����(����)
A��������������ѡ���Ǵ����
B���ҵ������ж�����̼ԭ�ӵı���Ǵ����
C����������������ѡ������ȷ��
D��������������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��100mL��FeBr2��Һ�У�ͨ���״����Cl2 5.04L��Cl2ȫ������ԭ�������Һ��c(Br-)=c(Cl-)����ԭFeBr2��Һ�����ʵ���Ũ����
A��0.75mol/L B��1.5mol/L C��2mol/L D��3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������ᣨ�ṹ��ʽ��ͼ��������ҵ��ˮ����ֳҵ����Ҫ����������������������ˮ������X��NH4HCO3�����й���X��˵������ȷ����
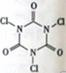
A.X�ĽṹʽΪH—Cl—O B.X��ǿ������
C.X�������� D.X���ڵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�������ɡ�������ȷ����
A�����ᡢ���ᡢ���ᶼ��ǿ��������
B��������ˮ��������Ҫ�Ǵ��������
C������ռ�ijɷֱַ���̼���ơ���������
D�������۱���ϩ������ϩ�����Ԫ���Լ�Ԫ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����β����CO��NOx �Լ�ȼú�����е�SO2���Ǵ�����Ⱦ������ǵ�����������Ҫ���塣
��CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ��H1= —574 kJ·mol- 1 ��
CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ��H2= һ1160 kJ·mol- 1
(1)����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
������SO2��NO�����Na2S2O4��NH4NO3��Ʒ������ͼ����(CeΪ��Ԫ��)��

(2)װ�â��У����������£�NO��Ce 4+ �����IJ�����Ҫ��NO3- ��NO2- ��д��ֻ����NO3- �����ӷ���ʽ ��
(3)װ�â������֮һ������Ce4+����ԭ������ͼ��ʾ��
�����ɵ�Ce4+ �ӵ��۵� (����ĸ���)��������
������S2O42 - �ĵ缫��ӦʽΪ ��
(4)��֪����װ�â�����Һ�У�NO2- ��Ũ��Ϊa g·L- 1 ��Ҫ
ʹ1m3����Һ�е�NO2- ��ȫת��ΪNH4NO3����������װ�â�
��ͨ���״���µ�O2 L��(�ú�a����ʽ��ʾ����������������)


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һЩ�����ı�ȼ�������±�:
| ������ | ��ȼ����(��H/kJ·mol��1) | ������ | ��ȼ����(��H/kJ·mol��1) |
| ���� | -891.0 | ������ | -2878.0 |
| ���� | -1560.8 | �춡�� | -2869.6 |
| ���� | -2221.5 | ������ | -3531.3 |
����˵����ȷ����
A.���ȶ���:������>�춡��
B.������ı�ȼ���ȴ�Լ�ǡ�H=-3540kJ·mol��1
C.����ȼ�յ��Ȼ�ѧ����ʽΪ
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ��H=-1560.8kJ·mol��1
D.��101kPa�£��������ֵ��891.0kJ·g��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�������;��˵���У���ȷ����( )
A�����������ɳ���ʢ�Ÿ����� B�����᳣��������ͭ�ӹ�ǰ����ϴ
C��̼���ƿ���������θ����� D������������������������ɫ�����Ϳ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com