
过碳酸钠俗称固体双氧水,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下:2Na2CO3+ 3H2O2![]() 2Na2CO3·3H2O2 ΔH<0,回答下列问题:
2Na2CO3·3H2O2 ΔH<0,回答下列问题:
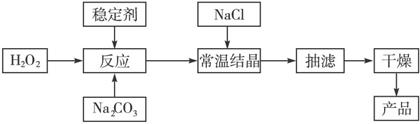
(1)与过碳酸钠的用途相关的化学性质是______________________。
(2)下列物质可使过碳酸钠较快失效的是________________________________。
A.MnO2 B.H2S C.稀硫酸 D.NaHCO3
(3)加入NaCl的作用是________________________________。
(4)工业纯碱中含有Fe3+等杂质,加入稳定剂的作用是与Fe3+生成稳定的配合物,Fe3+对反应的不良影响是________________________________。
(5)反应的最佳温度控制在15 ℃—
(6)以上生产流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是____________。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:

(1)滤液1中要加入稍过量的原料B,原料B的化学式是__________________________。
(2)如果省去步骤①,即溶解铝土矿从直接加入原料B开始,则最终会对氧化铝的生成有什么影响?_______________________________________。
(3)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,其中_____________极的材料随反应的进行需要不断补充,为什么?_______________________________________。
(4)铝粉与三氧化二铁粉末在引燃剂作用下常用来焊接钢轨,主要是利用了该反应_____________,而且该反应焊接速度快、设备简易,适于野外作业。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水资源的利用将走综合开发的道路,一次提取海水,同时提取多种物质。下图是某工厂对海水资源综合利用的示意图。

试回答下列问题:
(1)提纯粗盐后的母液中含有K+、Mg2+、Na+等阳离子,对母液进行一系列的加工可以制得金属镁。
①从充分利用当地海洋化学资源,提高生产与经济效益的角度考虑,生产石灰乳的化学方程式是__________________________________________。
②从离子反应的角度思考,在母液中加入石灰乳的目的是____________________________;
③在生产中,常涉及反应MgCl2·6H2O![]() MgCl2+6H2O,该反应需要在HCl气氛中才能顺利完成,其理由是_______________________。
MgCl2+6H2O,该反应需要在HCl气氛中才能顺利完成,其理由是_______________________。
(2)在提取Mg(OH)2后和剩余母液中加入一种常见的气态氧化剂,又可制取重要的化工原料溴单质。
①生产中将溴单质从混合物中分离出来的方法是_________________。
②以下是对生产溴单质所用的气态氧化剂寻找提供货源的设想,其中合理的是___________。
A.从外地购买
B.从本厂生产烧碱处循环
C.从本厂生产镁单质处循环
D.在当地新建生产工厂
③从多种经营综合开发,打造大而强的现代化企业及本厂生产所需要的原料等方面来看,你认为该厂还可以再增加的生产项目是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某省2007年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9 %,阳离子以铵根离子为主,约占阳离子总量的84.1 %。阴离子中![]() 和
和![]() 的质量比为4.13∶1,
的质量比为4.13∶1,![]() 的比例呈明显上升的趋势。
的比例呈明显上升的趋势。
回答下列问题:
(1)该省大气污染特征是_________
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)请你提出该省防治酸雨的两条主要措施_________________________;
(3)某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①参加该课题的探究,在小组讨论测定地点时,选择的测定地点分别是工厂、学校、村庄(或居民住宅区)、公园(或农田)等。
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262—94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是_______________________。③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:

该反应类型属于______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7 g NH4Cl,理论上需NaCl_______________g。
(2)实验室进行蒸发浓缩用到的主要仪器有_______________、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_______________。
(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是_______________。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com