
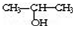 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2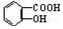 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备
| A. | 只有③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O | B. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | ||
| C. | Al(OH)3+3HNO3═Al(NO3)3+3H2O | D. | 3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
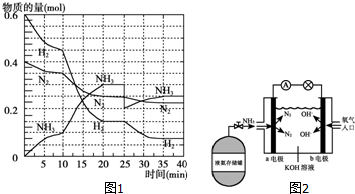 氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:
氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
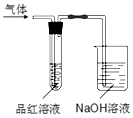 用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:
用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
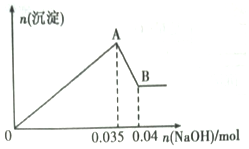 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.
某无色工业废水中可能含有Na+、Mg2+、Al3+、Cu2+、Cl-、SO42-中的几种离子.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
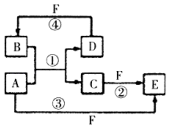 (1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题:
(1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题: ;
; ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
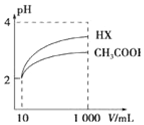 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学化学知识回答下列问题:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学化学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1molCl2全部溶于水形成的1L溶液中:2c(Cl2)+c(Cl-)+c(HClO)+c(ClO-)=0.2mol•L-1 | |
| B. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | 物质的量浓度均为0.1mol•L-1的NaClO与NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 室温下,向0.01mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com