
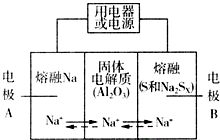
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
分析 (1)原电池工作时,控制的温度应为满足Na、S为熔融状态;
(2)Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此解答;
(3)电解NaCl溶液的反应式为,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,每生成2molNaOH转移电子2mol,当溶液的pH变为l3时,c(OH-)=0.1mol/L,生成NaOH物质的量为0.05mol,转移电子0.05mol;据转移电子数计算质量变化.
解答 解:(1)原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有c符合,故答案为:C;
(2)A.放电时,Na被氧化,应为原电池负极,故A正确;
B.阳离子向正极移动,即从A到B,故B错误;
C.A为负极,放电时发生氧化反应,充电时发生还原反应,接电源负极,故C错误;
D.充电时,是电解池反应,B为阳极,阳极反应为:Sx2--2e-=xS,故D正确;
故答案为:AD;
(3)电解NaCl溶液的反应式为,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,每生成2molNaOH转移电子2mol,当溶液的pH变为l3时,c(OH-)=0.1mol/L,生成NaOH物质的量为0.05mol,转移电子0.05mol;转移0.05mol电子,负极Na质量减少1.15g,正极质量变化1.15g,两极的反应物的质量差为2.3g,
故答案为:0.05;2.3.
点评 本题考查原电池知识,侧重于学生的分析能力和计算能力的考查,注意把握原电池的工作原理以及电极方程式的书写,答题时注意体会,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y分别与Z、W形成的化合物中化学键类型不相同 | |
| B. | 单质的沸点:Y>Z | |
| C. | X、Y、Z三种元素不可能形成离子化合物 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫气体通入硝酸钡溶液,生成白色BaSO4沉淀 | |
| B. | 氨气的水溶液可以导电,所以氨气是电解质 | |
| C. | 酸性高锰酸钾溶液中通入二氧化硫气体,溶液褪色,证明二氧化硫有漂白性 | |
| D. | 硝酸具有挥发性,所以硝酸不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe 与S混合加热生成FeS | |
| B. | Fe与Cl2反应生成FeCl2 | |
| C. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| D. | 氯气具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 解释或实验结论 |
| (1)称取M 4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)M的摩尔质量为:90g/mol. |
| (2)将此4.5g M在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | (2)M的分子式为:C3H6O3. |
| (3)通过M的红外光谱图发现该分子中既有羟基,还有羧基(--COOH) | (3)写出M中含有官能团羟基的电子式: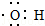 |
(4)M的核磁共振氢谱如图: | (4)M中含有4种氢原子. |
(5)综上所述,M的结构简式为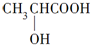 . . | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中通过量氨气:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+3H2O | |
| C. | 氢氧化钠溶液中通过量二氧化硫:SO2+2OH-═SO32-+H2O | |
| D. | 溴化亚铁溶液与足量氯水反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com