
(9分)1000mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(所加试剂均过量):

(1)写出生成白色沉淀B的离子方程式:_______________。
(2)待测液中肯定不存在的阳离子是_____________。
(3)若无色气体D是混合气体:
①待测液中一定含有的阴离子是__________。
②沉淀A中能还原稀硝酸的成分是________________(写化学式)。
科目:高中化学 来源:2016届浙江省新安江校区高三上学期第二次模拟化学试卷(解析版) 题型:推断题
(10分)酸牛奶是人们喜爱的一种营养饮料。酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖。酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用,乳酸的结构为:
工业上它可由乙烯来合成,方法如下:

(1)乳酸所含的官能团的名称是 .
(2)写出下列转化的化学方程式:
①A的生成 .
②C的生成 .
③乳酸在一定条件合成聚乳酸 .
(3)写出符合下列要求的乳酸的所有同分异构体的结构简式
a、属于酯类, b、含有-OH, c、能发生银镜反应
查看答案和解析>>
科目:高中化学 来源:2016届山东省邹城市高三上学期10月月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L CCl4中含Cl原子数目为0.4NA
B.白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA
C.1mol氯气参加氧化还原反应,转移的电子数一定为2 NA
D.5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上学期第一次月考化学试卷(解析版) 题型:选择题
有关化学实验的下列操作中,一般情况下不能相互接触的是
A.过滤操作中,玻璃棒与三层滤纸
B.过滤操作中,漏斗径与烧杯内壁
C.分液操作中,分液漏斗径与烧杯内壁
D.用胶头滴管向试管滴液体时,滴管尖端与试管内壁
查看答案和解析>>
科目:高中化学 来源:2016届河南省英文学校高三上学期期中测试化学试卷(解析版) 题型:选择题
24 mL 0.05 mol/L的 Na2SO3恰好与20 mL 0.02 mol/L的K2R2O7溶液完全反应,则R元素在还原产物中的化合价为
A.0 B.+2 C.+3 D.+6
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列实验设计能完成或实验结论合理的是
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用浓硫酸吸收二氧化硫中混有少量SO3气体
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
下列离子方程式表示正确的是
A.AgNO3 溶液中加入Cu :Cu+Ag+=Cu2++Ag
B.NaHCO3溶液中加入CH3COOH: CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
C.含0.2mol FeBr2 的溶液中通入0.2mol Cl2 :
4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:
HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016届浙江省瑞安市四校高三上学期第一次联考化学试卷(解析版) 题型:选择题
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是
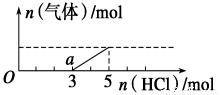
A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.常温下,a点溶液pH>7
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5mol/L
查看答案和解析>>
科目:高中化学 来源:2016届安徽省三校高三上学期二次模拟化学试卷(解析版) 题型:填空题
(6分)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO的浓度,某兴趣小组提出以下两种方案:
a.在微碱性条件下,用Fe(OH)2还原NO3-,还原产物为NH3;
b.在碱性条件下,用铝粉还原NO3-,还原产物为N2。
(1)方案a中,生成34g NH3的同时生成__________mol Fe(OH)3。
(2)方案b中发生的反应如下(配平该反应离子方程式):
______Al+______NO3-+______OH-===______AlO2-+______N2↑+______H2O
(3)方案b中,当有0.15 mol电子转移时,生成的氮气在标准状况下的体积为_________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com