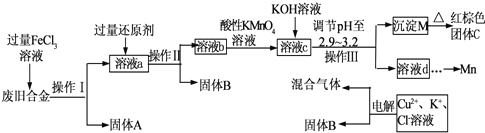
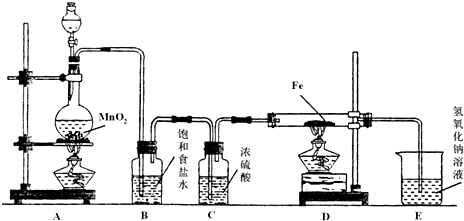
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素的性质递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.(已知常温下浓盐酸与高锰酸钾能反应生成氯气).

(1)甲同学设计的实验,固体B为大理石,试剂A为
①
①
(填序号);
①稀硝酸 ②浓盐酸 ③NaOH溶液 ④Na
2SiO
3溶液
(2)写出图1烧瓶中发生反应的离子方程式
2H++CaCO3=Ca2++H2O+CO2↑
2H++CaCO3=Ca2++H2O+CO2↑
;
(3)甲同学所做实验图1烧杯中现象为
出现白色沉淀
出现白色沉淀
;
(4)乙同学所做实验图2中B处的现象为
湿润的淀粉KI试纸变蓝
湿润的淀粉KI试纸变蓝
;
(5)写出图2中A处发生反应的离子方程式
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
;
(6)乙同学用图2来完成实验验证卤素单质氧化性:Cl
2>Br
2>I
2,你认为合理吗?
不合理
不合理
(填“合理”或“不合理”)理由是
通过B的气体主要是Cl2,即不能说明氧化性Br2>I2
通过B的气体主要是Cl2,即不能说明氧化性Br2>I2
.




 小学教材完全解读系列答案
小学教材完全解读系列答案