
| A. | 18 | B. | 16 | C. | 32 | D. | 不能确定 |
分析 18克葡萄糖(C6H12O6)与32克氧气充分反应生成二氧化碳和水蒸气,将生成的气体缓缓通过足量的过氧化钠固体,2Na2O2+2H2O=4NaOH+O2↑,固体增重为氢气质量,2Na2O2+2CO2=2Na2CO3+O2,固体增重为CO的质量,综上分析可知,H2、CO以及可拆写成(CO)m•Hn的形式的有机物能满足上述结果;
解答 解:18克葡萄糖(C6H12O6)与32克氧气充分反应生成二氧化碳和水蒸气,将生成的气体缓缓通过足量的过氧化钠固体,2Na2O2+2H2O=4NaOH+O2↑,固体增重为氢气质量,2Na2O2+2CO2=2Na2CO3+O2,固体增重为CO的质量,18克葡萄糖(C6H12O6)可以拆分为(CO)6•(H2)3,所以通过过氧化钠后固体增加为葡萄糖的质量为18g,故选A.
点评 本题考查了过氧化钠和二氧化碳、水蒸气反应的特征定量关系的分析,注意掌握反应特征和规律的总结应用,掌握基础是解题关键,题目难度中等.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
 ,
, 叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )| A. | 狄尔斯阿德而反应为加成反应,原子利用率为100% | |
| B. |  可通过狄尔斯阿德而反应合成,而 可通过狄尔斯阿德而反应合成,而 不可通过狄尔斯阿德而反应合成 不可通过狄尔斯阿德而反应合成 | |
| C. | 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种 | |
| D. |  可由环戊二烯与丙烯酸甲酯发生上述反应得到 可由环戊二烯与丙烯酸甲酯发生上述反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 常温下,将大小、形状形态的锌和铝分别加入到等体积98%的浓硫酸中,观察到前者反应速率快 | 锌比铝活泼 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定含有SO42- |
| C | 将盐酸滴入碳酸钠溶液中,产生气泡 | 非金属性:Cl大于C |
| D | 向某溶液中加入氢氧化钡溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/s | 0 | 10 | 20 | 30 | 40 |
| n(SO3)/mol | 0 | 0.6 | 1.0 | 1.2 | 1.2 |
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:填空题
分部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
① | A | A是一种常见金属,它的一种氧化物是具有磁性的黑色晶体 |
② | B | B是一种常见金属,原子核外有三个电子层且最外层电子为偶数 |
③ | C | C的气态氢化物易液化常作制冷剂 |
④ | D | D为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
⑤ | E | E原子最外层电子数是内层电子总数的3倍 |
⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为______________,离子半径:B2+_________C3-(填"大于、小于或等于”)。
(2)简单气态氢化物的热稳定性:D__________E(填"大于、小于或等于”)。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的电子式为__________,N的结构式为___________。
(4)用化学方程式表明C与E这两种元素的非金属性的强弱_________________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列关于某些离子检验的方法,其中说法正确的是
A.向某溶液中加稀盐酸,将产生的无色无味的气体通入过量的澄清石灰水中,石灰水变浑浊,则原溶液中一定存在CO32-或HCO3-
B.向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中一定存在SO42-
C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润的蓝色石蕊试纸变红,则原溶液中一定存在NH4+
D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀盐酸,沉淀不消失,则原溶液中一定存在Cl-
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考二化学试卷(解析版) 题型:选择题
下列实验现象预测正确的是

A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中无明显现象
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟二化学试卷(解析版) 题型:实验题
实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
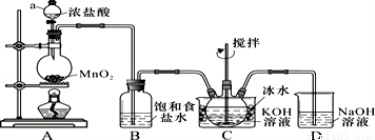
已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是 .
(2)C中得到足量KClO后将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度 为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 .再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 .再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,
② ,
③ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由_____________ .
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4﹣+FeO42﹣═Fe(OH)3↓+CrO42﹣+OH﹣;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为: .
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为: .计算该K2FeO4样品的纯度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com