
 ,在其化合物中,最高正价是+7;
,在其化合物中,最高正价是+7; ;
; ;
;分析 (1)由元素在周期表中位置,可知A为氢,B为Na,C为K,D为Mn,E为Fe,F为Al,G为碳,H为N,L为O,J为P,K为As,M为Cl,N为Ar;
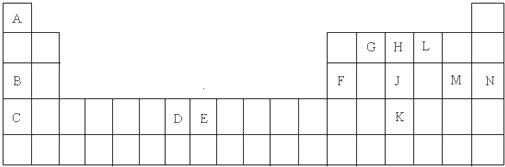
(2)D处于第四周期VIIB族,外围排布式为3d54s2;
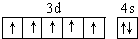
(3)C为K元素,原子核外有19个电子;
(4)A与L形成原子数目1:1的化合物是 H2O2,B与L形成原子数目1:1的化合物为Na2O2;
(5)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
(6)J单质的一种白色同分异构体为P4;
(7)由位置可知,E元素在元素周期表中的位置是第四周期第Ⅷ族,Fe3+的3d轨道为半充满结构,更稳定;
(8)A与B的化合物为NaH,属于离子晶体,A与L的化合物为H2O等,属于分子晶体;
(9)氢气、氧气与NaOH溶液能组成燃烧电池,原电池负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水;
(10)F元素的最高价氧化物为氧化铝,M元素的最高价氧化物的水化物为高氯酸,二者发生反应生成盐与水.
解答 解:(1)由元素在周期表中位置,可知A为氢,B为Na,C为K,D为Mn,E为Fe,F为Al,G为碳,H为N,L为O,J为P,K为As,M为Cl,N为Ar,
故答案为:As;
(2)D处于第四周期VIIB族,外围排布式为3d54s2,外围电子排布图为 ,最高正化合价为+7,
,最高正化合价为+7,
故答案为: ;+7;
;+7;
(3)C为K元素,原子核外有19个电子,原子结构示意图为: ,
,
故答案为: ;
;
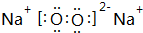
(4)A与L形成原子数目1:1的化合物是 H2O2,为展开书页型结构,为极性分子,B与L形成原子数目1:1的化合物为Na2O2,电子式为 ,
,
故答案为:极性; ;
;
(5)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,
故答案为:N>O>C;
(6)J单质的一种白色同分异构体为P4,为正四面体结构,
故答案为:正四面体;
(7)由位置可知,E元素在元素周期表中的位置是第四周期第Ⅷ族,Fe3+的3d轨道为半充满结构,更稳定,
故答案为:第四周期第Ⅷ族;Fe3+的3d轨道为半充满结构,更稳定;
(8)A与B的化合物为NaH,属于离子晶体,A与L的化合物为H2O等,属于分子晶体,故NaH的熔点更高,
故答案为:NaH是离子晶体,H2O是分子晶体;
(9)氢气、氧气与NaOH溶液能组成燃烧电池,原电池负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-=2H2O,
故答案为:H2-2e-+2OH-=2H2O;
(10)F元素的最高价氧化物为氧化铝,M元素的最高价氧化物的水化物为高氯酸,二者发生反应生成盐与水,反应方程式为:Al2O3+6HClO4=2Al(ClO4)3+3H2O,
故答案为:Al2O3+6HClO4=2Al(ClO4)3+3H2O.
点评 本题是对物质结构与性质的考查,涉及元素周期表、元素周期律、核外电子排布、电子式、分子结构与性质、原电池等,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
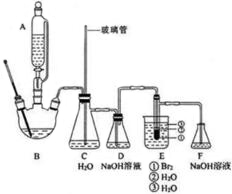 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2-二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象和结论 | |
| A | 在平衡3KSCN+FeCl3?Fe(SCN)3+3KCl的溶液中加入少量KCl溶液 | 溶液红色变浅,平衡逆向移动 |
| B | 向AgI沉淀中滴入KCl溶液 | 有白色沉生成,Ksp(AgCl)<Ksp(AgI) |
| C | 把Cl2通入品红溶液中 | 溶液褪色,Cl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色,氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氮元素被氧化 | |
| B. | 该反应中H2O2作还原剂 | |
| C. | 实验室配制NaCN溶液时,需加入适量的NaOH溶液 | |
| D. | 常温下,浓度均为0.1 mol•L-1 NaCN、NaHCO3溶液,前者的pH小于后者 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com