
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 第2周期 | ① | ② | ③ | |||||
| 第3周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第4周期 | ⑨ | ⑩ |
分析 由元素在周期表的位置可知,①~⑩元素分别为C、N、O、Mg、Al、S、Cl、Ar、K、Ca;
(1)由上述分析可知元素的名称;
(2)K的金属性最强,N的气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐为铵盐;
(3)利用氢化物的稳定性、与变价金属反应、最高价含氧酸等比较非金属性;
(4)设计成原电池,Al在负极失去电子生成偏铝酸根离子.
解答 解:由元素在周期表的位置可知,①~⑩元素分别为C、N、O、Mg、Al、S、Cl、Ar、K、Ca;
(1)元素的名称⑧为氩气,⑩为钙,故答案为:氩;钙;
(2)在①~⑩元素中,金属性最强的元素是K,气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐的元素是N,故答案为:K;N;
(3)a.常温下⑥的单质和⑦的单质状态不同,为物理性质,不能比较非金属性,故不选
b.⑦的氢化物比⑥的氢化物稳定,可知非金属性,故选;
c.一定条件下⑥和⑦的单质都能与氢氧化钠溶液反应,为物质的特性,不能比较非金属性,故不选;
d.一定条件下⑥和⑦的单质与Fe反应的产物不同,可知得电子的难易,故选;
故答案为:bd;
(4)⑤的单质可以与⑨的最高价氧化物的水化物的溶液反应,若将该反应设计成原电池,其负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
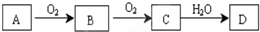
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
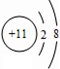 ,I的原子结构示意图
,I的原子结构示意图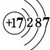 .
.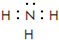 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
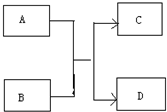 运用有关知识,回答下列问题.
运用有关知识,回答下列问题.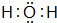 ,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.
,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 蔗糖变黑体现了浓硫酸的脱水性 | |
| B. | 蔗糖体积膨胀变成疏松多孔的海绵状物质炭 | |
| C. | 实验中有大量气体产生体现了浓硫酸的强酸性 | |
| D. | 将产生的气体通入品红溶液,溶液会褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com