
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 热稳定性:H2S>H2O>HF | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:F2>Cl2>Br2 |
分析 A、非金属性越强,最高价氧化物的水化物酸性越强;
B、金属性越强,气态氢化物越稳定;
C、金属性越强,最高价氧化物的水化物碱性越强;
D、依据元素周期律可知,从上到下,卤族元素的非金属性依次减弱,单质的氧化性依次减弱.
解答 解:A、非金属性Cl>S>P,最高价氧化物的水化物酸性为H3PO4<H2SO4<HClO4,故A正确;
B、非金属性F>O>S,气态氢化物的稳定性为HF>H2O>H2S,故B错误;
C、金属性Na>Mg>Al,碱性:NaOH>Mg(OH)2>Al(OH)3,故C正确;
D、依据元素周期律可知,从上到下,卤族元素的非金属性依次减弱,单质的氧化性依次减弱,故D正确,
故选B.
点评 本题考查元素的性质,为高频考点,把握同主族、同周期元素的性质比较规律为解答的关键,注意元素周期律的应用和规律性知识的归纳,题目难度不大.


科目:高中化学 来源: 题型:解答题
 可逆反应aA(g)+bB(g)?cC(g)+dD(g)的v-t图象如图所示.
可逆反应aA(g)+bB(g)?cC(g)+dD(g)的v-t图象如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证Br2的氧化性强于l2 | 将少量溴水加入Kl溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| B | 探究石蜡油分解的产物含有烯烃 | 将石蜡油加强热产生的气体通入溴的四氧化碳溶液中 |
| C | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水溶加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| D | 验证Na能置换出醇烃基中的氢 | 向一定量的无水乙醇中加入足量Na,测量生成气体的体积 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 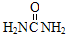 | B. | H2NCH2CH2NH2 | C. | (NH4)2CO3 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.
烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点.可以通过氧化还原反应或酸碱反应进行脱硫和脱硝.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2中既含离子键又含非极性键 | |
| B. | BF3分子中的所有原子共平面 | |
| C. | SiO2和Na2O2的晶体类型相同 | |
| D. | S的第一电离能大于P的第一电离能. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定含有Fe3+离子,不含Fe2+ | |
| B. | 原溶液中一定含有Fe2+离子,不含Fe3+ | |
| C. | 溶液中的Fe2+离子被氯气还原为Fe3+ | |
| D. | 溶液中同时含Fe2+或Fe3+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇所含的分子数为NA | |
| B. | 1mol/LCaCl2溶液中含有的氯离子数目为2NA | |
| C. | 1 mol金属钠在足量氧气中完全燃烧转移的电子数为2NA | |
| D. | 28g N2中含有的原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com