
| A. | Cl-浓度为0.2 mol/L | |
| B. | 取出10 mL溶液中Ba2+浓度为0.2 mol/L | |
| C. | 溶液中Cl-总数为0.2NA | |
| D. | 取出50 mL溶液中Ba2+和Cl-总数为0.03NA |
分析 A.氯化钡为强电解质完全电离,溶质电离出离子的浓度=溶质浓度×电离出离子数;
B.溶液具有均一性;
C.n=CV=$\frac{N}{{N}_{A}}$;
D.计算50 mL溶液中BaCl2物质的量,结合化学式和电离方程式计算离子总数;
解答 解:A.氯化钡为强电解质完全电离,500mL 0.2mol/L的BaCl2溶液中Cl-浓度为0.2 mol/L×2=0.4mol/L,故A错误;
B.500mL 0.2mol/L的BaCl2溶液中Ba2+浓度为0.2 mol/L,取出10 mL溶液中Ba2+浓度为0.2 mol/L,故B正确;
C.500mL 0.2mol/L的BaCl2溶液中溶质物质的量=0.50L×0.2mol/L=0.1mol,溶液中Cl-总数为0.2NA,故C正确;
D.取出50 mL溶液中溶质物质的量=0.050L×0.2mol/L=0.01mol,BaCl2=Ba2++2Cl-,溶液中Ba2+和Cl-总数为0.03NA,故D正确;
故选A.
点评 本题考查了物质的量浓度的有关计算,题目难度不大,注意溶液中不水解的离子的物质的量浓度与化学式和溶质的物质的量浓度有关,溶质浓度与溶液的体积无关,掌握基础是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
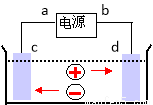
A.a为负极、b为正极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
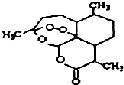 被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明’,的复方篙甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得)一泛认可的中国原创药品.截至2005年底,己被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青篙素(是一种由青篙中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H20O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 青篙素与维生素一样是水溶性的 | |
| D. | 该化合物中含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
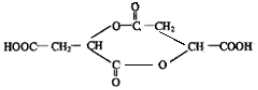 .
.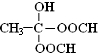 .(已知:
.(已知: )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由电子转移守恒和氯元素守恒可推出2b+a=6c | |
| B. | 若氯酸分解所得混合气体,在相同状态下密度是氢气的25.75信,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O | |
| C. | 由非金属性Cl>S,可推知酸性HClO4>H2SO4 | |
| D. | 若化学计量数a=3,b=2,则该反应转移电子数为10e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-═3Fe3++NO↑+4H2O | |
| B. | Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA | |
| B. | 56g的铁发生氧化还原反应,一定失去3NA个电子 | |
| C. | 标准状况下,22.4L氧气和二氧化碳混合气体中所含氧原子数为2NA | |
| D. | 0.1mol/L稀硫酸中含有SO42-离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) △H=-1 025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
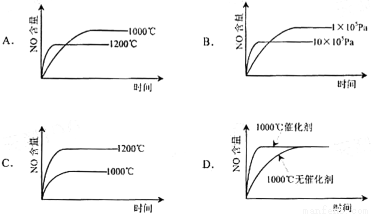
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com