
| A. | 平衡时两容器中I2的物质的量相等 | |
| B. | 平衡时两容器中I2的浓度相等 | |
| C. | 平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器 | |
| D. | 平衡时HI的分解率:αA=αB |
分析 容器A中反应物浓度大于容器B,但效果只是A中反应速率快,所需时间短,由于A容器中物质浓度大,故A的压强较大,增大压强反应向气体体积减小方向进行.但因为这个反应前后物质计量数之和都是2,所以不存在气体体积减小方向,平衡不移动,即压强对转化率没有影响,当平衡时A、B中HI的转化率是相同的.由于A中投料多,所以HI转化为更多的碘,体积相同,所以A容器中碘蒸气浓度更高.
解答 解:A、容器中A中反应物的物质的量大于B中反应物的物质的量,故A错误;
B、A容器中各物质的浓度比B容器中各物质的浓度大,故B错误;
C、平衡时A、B中HI的转化率相同,设转化率为x,平衡时A容器中:HI物质的量为a-ax,H2和I2均为$\frac{1}{2}$ax;平衡时B容器中:HI物质的量为b-bx,H2和I2为$\frac{1}{2}$bx,体积百分含量(也就是物质的量的百分含量)为$\frac{1}{2}$x,所以是相同的,故C错误;
D、两容器中平衡时HI的分解率相同,故D正确;
故选:D.
点评 本题考查了反应前后气体体积不变的化学反应的等效平衡,在达到平衡时的各量的变化,化学平衡的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液都是均一、稳定的分散系,静置不易产生沉淀 | |
| B. | 蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔现象 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀硫酸会产生先沉淀而后沉淀逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁烷在常温下是气体 | |
| B. | C4H10与 C(CH3)4 互为同系物 | |
| C. | CH3CH2CH2CH3分子中四个碳原子排列成一条直线 | |
| D. | C4H10进行一氯取代后可生成四种沸点不同的有机产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.4mol/L | B. | 17.4mol/L | C. | 18.4mol/L | D. | 19.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

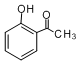 ;②
;②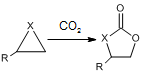 ( X=O,N,S;R为烃基); ③RCOOR+2R′OH→R′COOR′+2ROH
( X=O,N,S;R为烃基); ③RCOOR+2R′OH→R′COOR′+2ROH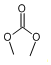 .
.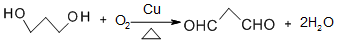 .
.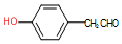 .
.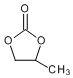 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.验证FeCl3溶液中是否含有Fe2+ | B.检验溴乙烷消去的产物 |
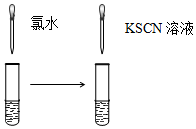 | 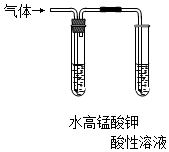 |
| C.检验氯气与亚硫酸钠是否发生反应 | D.对比Fe3+和Cu2+对H2O2分解的催化效果 |
 反应后混合液 | 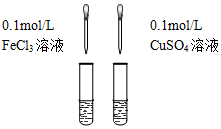 等体积5%的H2O2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标况下,燃烧1mol S放出的热量为297.23 kJ | |
| B. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量大于297.23 kJ | |
| C. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com