
分析 (1)①反应2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O中,次氯酸根中氯元素的化合价降低,所以氧化剂是NaClO,NaClO是强碱弱酸盐溶液水解呈碱性;
②根据复分解反应原理,反应的化学方程式为2KOH+Na2FeO4═K2FeO4+2NaOH;
(2)高铁酸钾中铁元素的化合价+6价,处高价态具有极强的氧化性,根据氧化还原反应电子得失守恒配平.
解答 解:(1)反应①2Fe3++3ClO-+10OH-═2FeO42-+3Cl-+5H2O中,次氯酸根中氯元素的化合价降低,所以氧化剂是NaClO,NaClO是强碱弱酸盐溶液水解呈碱性,故答案为:NaClO;碱;
②根据复分解反应原理,反应的化学方程式为2KOH+Na2FeO4═K2FeO4+2NaOH,故答案为:2KOH+Na2FeO4═K2FeO4+2NaOH;
(2)高铁酸钾中铁元素的化合价+6价,处高价态具有极强的氧化性,据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,故答案为:氧化;4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-.
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、盐溶液的酸碱性等,培养了学生运用知识的能力,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
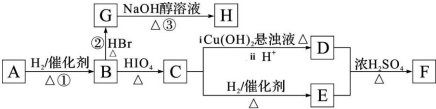
 .若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
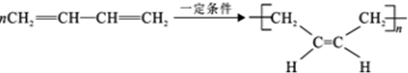
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
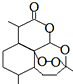 1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )
1971年,中国科学家发现、分离、提纯了用于治疗疟疾的“青蒿素”,拯救了数千万人的生命.屠呦呦起了重要的作用,因而与另两位外国科学家获得2015年诺贝尔医学奖.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素可以起取代反应 | B. | 青蒿素中的氧均为-2价 | ||
| C. | 青蒿素可以和NaOH溶液反应 | D. | 青蒿素的分子式为C15H22O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
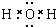 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10B的质子数是10 | B. | 10B的中子数与核外电子数不同 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B20具有较强的化学活性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加KSCN溶液并振荡 | 溶液变红色 | 反应①所致 |
| 2 | 取所述黄色溶液于试管中,滴加CCl4并振荡 | 溶液分上下两层,上层为黄色、下层为无色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中 | |
| D. | 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com