
分析 (1)Cu与浓硝酸反应制备二氧化氮;
(2)Cu2S+2Cu2O═6Cu+SO2↑中,Cu元素的化合价降低,S元素的化合价升高;
(3)炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,加盐酸溶液后,过滤分离出SiO2,滤液中含铁离子、亚铁离子和铝离子,将亚铁离子氧化后加NaOH足量,过滤分离出氢氧化铁,煅烧得Fe2O3,结合亚铁离子具有还原性及发生的反应来解答.
解答 解:(1)①Cu与浓硝酸反应制备二氧化氮,离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)Cu2S+2Cu2O═6Cu+SO2↑中,Cu元素的化合价降低,S元素的化合价升高,则还原剂为Cu2S,由反应即Cu元素的化合价变化可知生成6molCu转移6mol电子,则每生成1mol Cu,反应中转移电子的物质的量为1mol,故答案为:Cu2S;1mol;
(3)炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,加盐酸溶液后,过滤分离出SiO2,滤液中含铁离子、亚铁离子和铝离子,将亚铁离子氧化后加NaOH足量,过滤分离出氢氧化铁,煅烧得Fe2O3,结
a.上述②中NaOH过量,氢氧化铝可溶于强碱溶液中,则炉渣中的Al2O3变成[Al(OH)4]- 或AlO2-,故答案为:[Al(OH)4]- 或AlO2-;
b.因亚铁离子具有还原性,能使高锰酸钾褪色,则选择试剂为稀硫酸、酸性KMnO4溶液,实验验证炉渣中含有FeO的现象为用稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色,
故答案为:稀硫酸、酸性KMnO4溶液;用稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色.
点评 本题考查物质的制备及氧化还原反应,为高频考点,把握物质的性质、发生的反应等为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应应用及物质检验等,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的气化、液化都是物理变化 | |
| B. | 以淀粉为原料可制取乙酸乙酯 | |
| C. | 分子式为C4H9Cl的同分异构体有2种 | |
| D. | 聚乙烯、丙炔、裂化汽油都可以使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E的单质是日常生活中用量最大的金属材料 |
 .写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA | |
| B. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| C. | 常温常压下,3.2 g O2和3.2 g O3所含氧原子数都是0.2NA | |
| D. | 50mL18.4mol•L-1的浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
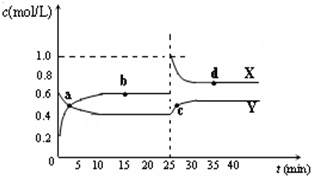
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
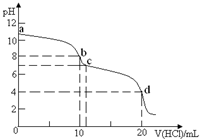 室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.1mol•L-1HCl溶液滴定10mL0.1mol•L-1K2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | a点时:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | b点时:c(K+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | d点时,溶液中存在电离平衡:H2CO3?2H++CO32- | |
| D. | 由水电离产生的c(H+)大小顺序为:b<c<d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com