
过渡金属配合物的一些特有性质的研究正受到许多研究人员的关注,因为这方面的研究无论是理论上还是工业应用上都具有重要意义。
(1)铜离子与氨基酸形成的配合物具有杀菌、消炎和抗肿瘤活性。与铜属于同一周期,且未成对电子数最多的元素基态原子的核外电子排布式为____________________。
(2)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤电子对,C、O原子都符合8电子的稳定结构,CO的结构式为________,与CO互为等电子体的离子为________________________________________________________________________
(填化学式)。C、N、O三种元素的第一电离能由大到小的顺序为____________。
(3)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子的结构如图K345所示:
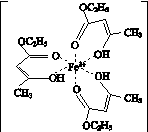
图K345
①此配离子中含有的作用力有______________(填字母)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.σ键 H.π键
②此配合物中碳原子的杂化轨道类型有____________。
(4)Ti3+可形成配位数为6的配合物。现有钛的两种颜色的配合物,一种为紫色,另一种为绿色。相关实验证明,两种物质的组成皆为TiCl3·6H2O。为测定这两种配合物的成键情况,设计了如下实验:分别取等质量的两种物质的样品配成待测溶液;分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀;测定沉淀质量并比较,发现由原绿色物质得到的沉淀质量是由原紫色物质得到的沉淀质量的2/3。则原绿色配合物的内界的化学式为____________。
(1)1s22s22p63s23p63d54s1或[Ar]3d54s1
(2)C≡O CN- N>O>C
(3)①CDEGH ②sp2、sp3
(4)[TiCl(H2O)5]2+
[解析] (1)铜位于第四周期,该周期中未成对电子数最多的元素中3d轨道上应是半充满状态,4s轨道上也是半充满状态,为Cr元素,其基态原子的核外电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1。
(2)C原子最外层有4个电子,O原子最外层有6个电子,当二者都符合8电子的稳定结构时,电子式为∶C⋮⋮O∶,即C与O之间形成共价三键,结构式为C≡O;CO分子共含有14个电子,与其互为等电子体的离子为CN-;同周期元素自左到右,第一电离能有增大的趋势,第ⅡA族元素和ⅤA族元素由于是全充满(ⅡA族)或半充满(ⅤA族)的稳定结构,故第一电离能要高于其相邻的主族元素,即三者第一电离能的大小顺序为N>O>C。
(3)①在该配离子中含有C—O、C—H等极性键,含有C—C非极性键,O与Fe3+之间的配位键,C—C、C—O、C—H、O—H等σ键,C===O之间、C===C之间含有π键。
②碳碳双键和碳氧双键中的碳原子采用sp2杂化,—CH3和—CH2-中的碳原子采用sp3杂化。
(4)两种物质的溶液中加入AgNO3溶液后都生成白色沉淀,说明外界中都含有Cl-,由得到沉淀的量的关系可知,绿色物质中的Cl中有2个在外界,而紫色物质中的Cl全部在外界,故绿色物质的内界的化学式为[TiCl(H2O)5]2+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
X、Y两种有机物的分子式不同,但均含有C、H或C、H、O,将X、Y以任意比例混合 只要物质的量之和不变,完全燃烧时所消耗的氧气量和生成水的物质的量也分别不变则下列有关判断正确的是: ( )
A、X、Y分子式中氢原子数不一定要相同,碳原子数必定不同
B、若X为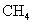 ,则相对分子质量最小的Y是甲醇
,则相对分子质量最小的Y是甲醇
C、若X为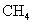 ,则相对分子质量最小的Y是乙二醇
,则相对分子质量最小的Y是乙二醇
D、X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确 的是( )
的是( )
A.AgCl在饱和NaCl溶液中的Ksp和在纯水中的Ksp相同
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为浅黄色,说明Ksp(AgCl)<Ksp(AgBr)
C.将0.001 mol/L的AgNO3溶液滴入0.001 mol/L的KCl和0.001 mol/L的K2CrO4溶液中先产生Ag2CrO4沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物中,含有非极性共价键的离子化合物是( )
A.CaC2 B.N2H4
C.Na2S2 D.NH4NO3
Ⅱ. [2013·海南卷] (14分)
图(a)所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸。a的一种同素异形体的晶胞如图(b)所示。
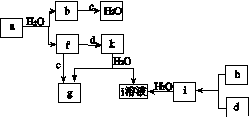
(a)

(b)
回答下列问题:
(1)图(b)对应的物质名称是________,其晶胞中的原子数为________,晶体的类型为________。
(2)d中元素的原子核外电子排布式为____________。
(3)图(a)中由二种元素组成的物质中,沸点最高的是________,原因是____________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图(a)中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学们按照下面的实验方法制备氢氧化铁胶体:首先取少量蒸馏水于洁净的烧杯中,用酒精灯加热至沸腾,向烧杯中逐滴滴加饱和的FeCl3溶液继续煮沸,至液体呈透明的红褐色。
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
(1)判断胶体制备是否成功,可利用胶体的____________________。
(2)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现象并分析原因:
①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到________________,其原因是______________________________________________________________。
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会________________,原因是__________________________________________
____________________________________________________。
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会_______ _________,原因是_________________________________________
_________,原因是_________________________________________
_______________________________________________________。
(3)丁同学按要求制备了Fe(OH)3胶体,但是他又向Fe(OH)3胶体中逐滴加入了稀H2SO4溶液,结果出现了一系列变化。
①先出现红褐色沉淀,原因是___________________________________
________________________________________________________。
②随后沉淀溶解,此反应的离子方程式为_________________________
__________________________ ________________________________。
________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(1)写出铜溶解于上 述混合液的离子方程式_____________________________。
述混合液的离子方程式_____________________________。
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是________ g,溶液中的c(SO )=________ mol/L。
)=________ mol/L。
(3)若欲在如图所示的装置中发生(1)中的反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中。
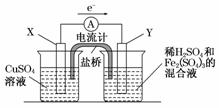
| 正、负极判断 | 电极材料 | 电极反应式 | |
| X极 | |||
| Y极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com