

| 1 |
| 2 |
| 0.5×0.5 |
| 1.5×0.5 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
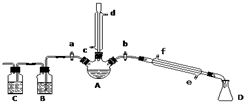 某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:查看答案和解析>>
科目:高中化学 来源: 题型:
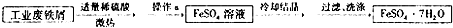
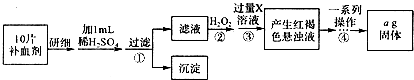
查看答案和解析>>
科目:高中化学 来源: 题型:
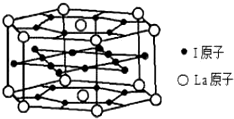
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 操 作 | 答案 | 实 验 现 象 |
| (1)让一束光通过Fe(OH)3胶体 | A.棕色烟 B.生成白色胶状沉淀 C.呈现光亮的“通路” D.呈黄色 | |
| (2)向盛有AlCl3溶液的试管中加入氨水 | ||
| (3)用铂丝蘸取碳酸钠溶液,在无色火焰上灼烧,观察火焰 | ||
| (4)把红热铁丝插入盛Cl2的集气瓶中,铁丝燃烧并产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
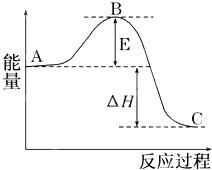 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
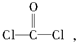 每个COCl2分子内含有
每个COCl2分子内含有查看答案和解析>>
科目:高中化学 来源: 题型:
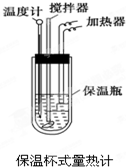 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com