
| A. | 醋酸溶液的浓度为0.01mol/L | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol/L | |
| C. | 冰醋酸晶体的加入抑制了水的电离 | |
| D. | 该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
分析 A.25℃时pH=2,溶液中氢离子浓度为10-2mol/L,即醋酸溶液的浓度为0.01mol/L;
B.水的离子积常数为1×10-14,水电离出来的氢离子浓度等于溶液中氢氧根离子的浓度;
C.加入酸或碱对水的电离起抑制作用;
D.常温下Kw=1×10-14,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,根据氢离子和氢氧根离子的物质的量及反应后溶液的成分判断溶液酸碱性.
解答 解:A.25℃时pH=2,溶液中氢离子浓度为10-2mol/L,即醋酸溶液的浓度为0.01mol/L,故A正确;
B.水的离子积常数为1×10-14,水电离出来的氢离子浓度等于溶液中氢氧根离子的浓度,即为$\frac{Kw}{c({H}^{+})_{溶液}}$=$\frac{1×1{0}^{-14}}{1{0}^{-2}}$=1×10-12mol/L,故B正确;
C.加入酸或碱对水的电离起抑制作用,故C正确;
D.常温下Kw=1×10-14,pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,两种溶液的体积相等,则n(H+)=n(OH-),反应后溶液的溶质为醋酸钠,为强碱弱酸盐,溶液显碱性,故D错误;
故选D.
点评 本题考查了水的电离、溶液pH的简单计算,题目难度中等,注意掌握水的电离平衡及其影响因素,明确溶液pH的计算方法,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 先加硝酸酸化,再加氯化钡溶液 | B. | 先加硝酸酸化,再加硝酸钡溶液 | ||
| C. | 先加盐酸酸化,再加氯化钡溶液 | D. | 先加盐酸酸化,再加硝酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| B. | (NH4)2SO4、K2SO4、NH4C1三种物质不能用一种试剂通过化学反应区别开 | |
| C. | 可以用BaCl2溶液和稀硝酸检验Na2SO3 是否变质 | |
| D. | 用湿润的KI淀粉试纸可以检验氯化氢气体中是否含有氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相同的粒子一定属于同一种元素 | |
| B. | 同一元素的核素种数由中子数决定 | |
| C. | 同位素的化学性质几乎相同 | |
| D. | 质子数相同、电子数也相同的两种粒子,不可能是一种分子和一种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(A)=0.25mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.3mol/(L•min) | D. | v(D)=0.1mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥ | B. | ①② | C. | ③⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素对应的离子半径:Z>M>R>W | |
| B. | 简单氢化物的沸点:W>R>Y>X | |
| C. | 气态氢化物的稳定性:X>Y>R>W | |
| D. | Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
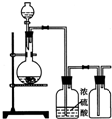
| A. | 铜和稀硝酸制一氧化氮 | B. | 亚硫酸钠与浓硫酸制二氧化硫 | ||
| C. | 锌和稀硫酸制氢气 | D. | 烧碱固体与浓氨水制氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com