
【题目】已知25%的酒精密度为0.96 g·cm-3,5%的酒精密度为0.99 g·cm-3。若将上述两溶液等体积混合,所得酒精溶液的质量分数是 ( )
A. 等于15% B. 大于15%
C. 小于15% D. 无法估算
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. ρ=(17V+22 400)/(22.4+22.4V)
B. ω=17c/(1 000ρ)
C. ω=17V/(17V+22 400)
D. c=1 000Vρ/(17V+22 400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2、CH4、N2O等气体都是“温室气体”.下列有关说法正确的是( )
A.CO2是一种混合物
B.CH4是一种无机物
C.N2O是由N2与O2组成的混合物
D.CO2是由C元素和O元素组成的纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于石油的说法不正确的是( )
A.石油主要含C、H两种元素
B.石油通过催化重整可得到环状烃
C.石油裂化是物理变化
D.石油分馏得到的汽油是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
① 反应中被还原的元素是________(填元素符号),
② 生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为___________________
② 证明炉渣中含有FeO的实验现象为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去.已知室温下Ksp(FeS)=6.3×10﹣18mol2L﹣2 , Ksp(CuS)=1.3×10﹣36mol2L﹣2 . ①请用离子方程式说明上述除杂的原理 .
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是(填序号)
A.Ba(NO3)2B.BaCl2
C.Ba(OH)2D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 .
(2)电解法处理酸性含铬废水(主要含有Cr2O72﹣)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是(填序号)
A.阳极反应为Fe﹣2e﹣═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72﹣被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池.图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作极(填“正”“负”“阴”或“阳”),其电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种重要的污水处理剂,具有易与水反应、易被氧化的性质。某兴趣小组在实验室中制备无水FeCl2并测定其纯度,设计了如下实验(夹持装置已略去,I中各装置不重复使用)。
Ⅰ.FeCl2的制备
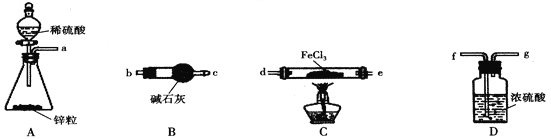
(1)加热条件下,H2与FeCl3制备无水FeCl2的化学方程式为______________________。
(2)按气流从左到右的方向,上图中装置合理的连接顺序为_________________(用仪器接口处的字母表示)。
(3)装置B的作用为____________。
(4)反应结束后,应先熄灭C处的酒精灯还是先关闭A处分液漏斗的活塞_______________(填“熄灭酒精灯”或“关闭活塞”)。
Ⅱ.FeCl2的纯度测定
已知:①实验得到固体的成分为FeCl2和FeCl3。
②Fe3+与K3[Fe(CN)6]不反应,3Fe2++2 [Fe(CN)6]3-![]() Fe3[Fe(CN)6]2↓。
Fe3[Fe(CN)6]2↓。
该兴趣小组设计了如下实验测定得到的FeCl2和FeCl3混合物中FeCl2的纯度。
(i)称取m g反应后的固体溶于过量盐酸中,再将所得溶液加水稀释到200 mL。
(ii)准确量取20 mL上述溶液于烧杯中,加入过量的K3[Fe(CN)6]溶液,有蓝色的Fe3[Fe(CN)6]2沉淀生成。
(iii)过滤、洗涤、干燥后进行称量,得到W g蓝色固体。
(5)产品中FeCl2的质量分数为____________________________(用含有m和ω的式子表示)。甲同学认为按照上述方案测得的FeCl2的质量分数偏低,他的理由为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol CO2的质量为44g/mol
B. H2SO4的摩尔质量为98
C. 标准状况下,气体摩尔体积约为22.4 L
D. O2的相对分子质量为32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com