
| A. | pH=3的盐酸中:c(H+)=3.0mol•L-1 | |
| B. | NaHS溶液中:c(Na+)=c(HS-)+2c(S2-) | |
| C. | 饱和AgI溶液与饱和AgCl溶液相比,前者c(Ag+)大 | |
| D. | 碳酸氢钠溶液中既存在电离平衡,又存在水解平衡 |
分析 A、pH=-lgc(H+);
B、HS-即电离也水解,水解生成H2S;
C、AgI比AgCl更难溶;
D、碳酸氢根离子既可以电离又可以水解.
解答 解:A、pH=3的盐酸中:c(H+)=10-3mol•L-1,故A错误;
B、据物料守恒,NaHS溶液中:c(Na+)=c(HS-)+c(S2-)+c(H2S),故B错误;
C、饱和AgI溶液与饱和AgCl溶液相比,后者c(Ag+)大,故C错误;
D、碳酸氢钠溶液中既存在碳酸氢根离子的电离平衡,又存在碳酸氢根离子的水解平衡,故D正确;
故选D.
点评 本题考查了pH的计算、溶液中的物料守恒、沉淀的溶度积、弱酸的酸式根离子的电离平衡和水解平衡,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3:2 | B. | 2:1 | C. | 8:1 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2+2HCl═CaCl2+2HClO | B. | Ca(ClO)2+2H2O+2CO2═Ca(HCO3)2+2HCl | ||
| C. | NaClO+H2O+CO2═NaHCO3+HClO | D. | 2NaClO+H2O+CO2═Na2CO3+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
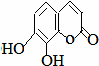 瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.
瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:1 | B. | 5:1 | C. | 7:1 | D. | 4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com